Reacción exergónica: características y ejemplos
Una reacción exergónica es aquella que ocurre espontáneamente y que, por lo general, viene acompañada de una liberación de energía, ya sea en forma de calor, luz o sonido. Cuando se libera calor, se dice que estamos frente a una reacción exotérmica y exergónica.
Es por eso que se confunden los términos ‘exotérmico’ y ‘exergónico’, llegando a ser tratados equivocadamente como sinónimos. Esto se debe a que muchas reacciones exotérmicas también son exergónicas. Por lo tanto, si se observa un gran desprendimiento de calor y luz, como el originado al encender una fogata, puede suponerse que consiste de una reacción exergónica.

No obstante, la energía liberada puede pasar desapercibida y no ser tan sorprendente. Por ejemplo, un medio líquido puede calentarse levemente y aun así ser consecuencia de una reacción exergónica. En algunas reacciones exergónicas que transcurren con demasiada lentitud, ni siquiera se observa el menor incremento de temperatura.
El punto central y característico de este tipo de reacciones termodinámicas es el descenso de la energía libre de Gibbs en los productos respecto a los reactivos, lo cual se traduce en espontaneidad.
Índice del artículo
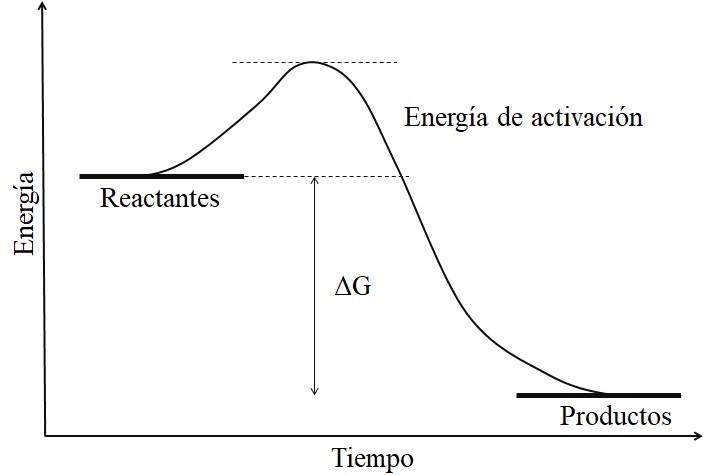
La principal característica de una reacción exergónica es que los productos presentan energías libres de Gibss menores que las de los reactantes o reactivos (imagen superior). Este hecho suele asociarse a que los productos son químicamente más estables, con enlaces más fuertes, estructuras más dinámicas o condiciones más “cómodas”.
Por lo tanto, esta diferencia de energía, ΔG, es negativa (ΔG 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Todas estas variables que responden a la naturaleza del fenómeno o de la reacción química considerados, permiten determinar si una reacción será o no exergónica. Y se verá asimismo que no necesariamente tiene que ser una reacción exotérmica.
Cuando la energía de activación es muy elevada, los reactantes requieren de la ayuda de un catalizador para disminuir dicha barrera energética. Es por eso que hay reacciones exergónicas que se dan a muy bajas velocidades, o que no ocurren en absoluto en primer lugar.
La siguiente expresión matemática engloba lo comentado arriba:
ΔG = ΔH – TΔS
El término ΔH es positivo si se trata de una reacción endotérmica, y negativo si es exotérmica. Si queremos que ΔG sea negativo, el término TΔS debe ser muy grande y positivo, para que al restarse a ΔH el resultado de la operación sea también negativo.
Por lo tanto, y esta es otra característica especial de las reacciones exergónica: implican un cambio grande en la entropía del sistema.
Es así que teniendo en cuenta todos los términos, podemos estar presentes ante una reacción exergónica pero al mismo tiempo endotérmica; esto es, con ΔH positivo, una temperatura muy alta, o un cambio de entropía grande.
La mayoría de las reacciones exergónicas son también exotérmicas, porque si ΔH es negativo, y al restarle otro término todavía más negativo, tendremos en consecuencia un ΔG con valor negativo; a menos que TΔS sea negativo (desciende la entropía), y por ende la reacción exotérmica pasaría a ser endergónica (no espontánea).
Es importante resaltar que la espontaneidad de una reacción (si es exergónica o no), depende enormemente de las condiciones termodinámicas; mientras que la velocidad con que transcurre, se debe a factores cinéticos.
De lo que se ha dicho se sabe ya que una reacción exergónica es espontánea, sea o no exotérmica. Por ejemplo, un compuesto puede disolverse en agua enfriándola junto con su recipiente. Este proceso de disolución es endotérmico, pero al suceder espontáneamente, se dice que es exergónico.
Existen reacciones “más exergónicas” que otras. Para averiguarlo, conviene tener a mano otra vez la siguiente expresión:
ΔG = ΔH – TΔS
Las reacciones más exergónicas son aquellas que se dan espontáneamente a todas las temperaturas. Es decir, sin importar cuál sea el valor de T en la expresión anterior, ΔH es negativo y ΔS positivo (ΔH 0 y ΔS > 0). Son pues, reacciones muy exotérmicas, lo cual no contradice la idea inicial.
Asimismo, puede haber reacciones exotérmicas donde disminuya la entropía del sistema (ΔS 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Por otro lado, hay reacciones que solo son espontáneas a temperaturas altas: cuando ΔH es positivo y ΔS positivo (ΔH > 0 y ΔS > 0). Hablamos de las reacciones endotérmicas. Es por eso que los descensos de temperatura pueden darse espontáneamente, pues llevan consigo un incremento de la entropía.
Mientras, hay reacciones que no son exergónicas en lo absoluto: cuando ΔH y ΔS tienen valores positivos. En este caso, no importa cuál sea la temperatura, la reacción nunca ocurrirá espontáneamente. Hablamos pues, de una reacción endergónica no espontánea.
La química suele caracterizarse por ser explosiva y brillante, por lo que es de suponerse que la mayoría de las reacciones sean exotérmicas y exergónicas.
Son reacciones exergónicas las combustiones de los alcanos, olefinas, hidrocarburos aromáticos, azúcares, etc.
Asimismo, las oxidaciones de los metales son exergónicas, aunque transcurren con más lentitud.
No obstante, hay otros procesos, más sutiles, que también son exergónicos y muy importantes: las reacciones catabólicas de nuestro metabolismo. Aquí se descomponen macromoléculas que actúan como reservorios de energía, liberándose en forma de calor y ATP, y gracias a la cual el organismo desempeña muchas de sus funciones.
La más emblemática de estas reacciones es la respiración celular, opuesta a la fotosíntesis, donde se “quema” carbohidratos con el oxígeno para transformarlos en moléculas pequeñas (CO2 y H2O) y energía.
Entre otras reacciones exergónicas tenemos la descomposición explosiva del triyoduro de nitrógeno, NI3; la adición de metales alcalinos al agua, seguido de una explosión; las síntesis poliméricas de resinas etoxiladas; las neutralizaciones ácido-base en disolución acuosa; y las reacciones quimio luminiscentes.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Physical Chemistry. In Chemical kinetics. Fourth edition, Longmans.
- Ira N. Levine. (2009). Principios de fisicoquímica. Sexta edición, pág 479-540. Mc Graw Hill.
- Wikipedia. (2020). Exergonic reaction. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (16 de septiembre de 2019). Endergonic vs Exergonic Reactions and Processes. Recuperado de: thoughtco.com
- Exergonic Reaction: Definition & Example. (18 de septiembre de 2015). Recuperado de: study.com
- Khan Academy. (2018). Energía libre. Recuperado de: es.khanacademy.org
