Modificaciones postraduccionales: concepto, proceso, ejemplos
¿Qué son las modificaciones postraduccionales?
Las modificaciones postraduccionales son modificaciones o alteraciones químicas reversibles o irreversibles que se dan en la cadena peptídica de las proteínas eucariotas durante o después de su traducción (biosíntesis), aumentando considerablemente la diversidad funcional de las proteínas celulares.
La traducción es el resultado de la “lectura e interpretación” de la información contenida en los genes que se encuentran en el núcleo eucariota (también ocurre en los procariotas).
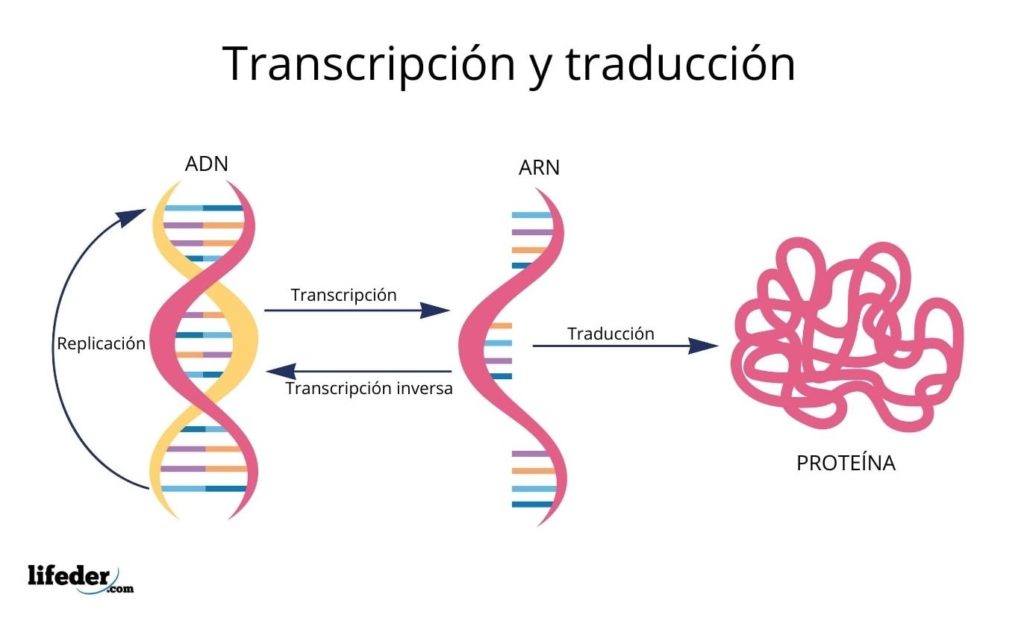
El conjunto de genes de una célula –genoma– es donde están las instrucciones para producir todas las proteínas estructurales y las enzimas que se encuentran en el interior celular, de las que dependen los procesos y funciones vitales de cada célula.
Los genes están formados por ADN (ácido desoxirribonucleico), que es una macromolécula formada por dos cadenas complementarias de un polímero compuesto por 4 tipos de moléculas diferentes llamadas bases nitrogenadas, a saber: adenina, timina, guanina y citosina.
El ADN, entonces, es una especie de alfabeto con información que se lee y se traduce.
Antes de la traducción, la información en el ADN primero es transcrita dentro del núcleo a otra molécula muy similar, el ARN (ácido ribonucleico), en forma de unas moléculas llamadas ARN mensajeros, que después son transportados hacia el citosol.
El ARN es muy similar al ADN, pero está formado por una sola cadena compuesta por las bases nitrogenadas adenina, uracilo, guanina y citosina.
Los ARN mensajeros, derivados de las secuencias genéticas codificantes de proteínas, posteriormente son “leídos” y su secuencia es traducida en las secuencias peptídicas de las proteínas celulares con ayuda de los ribosomas y otras moléculas de ARN conocidas como ARN de transferencia que, como su nombre lo indica, transfieren los aminoácidos adecuados a la proteína que se sintetiza.
El orden en el cual se añaden estos aminoácidos en las proteínas nacientes está dictado por la secuencia de los genes que las codifican, es decir, por el orden de las bases nitrogenadas en la secuencia del ADN.
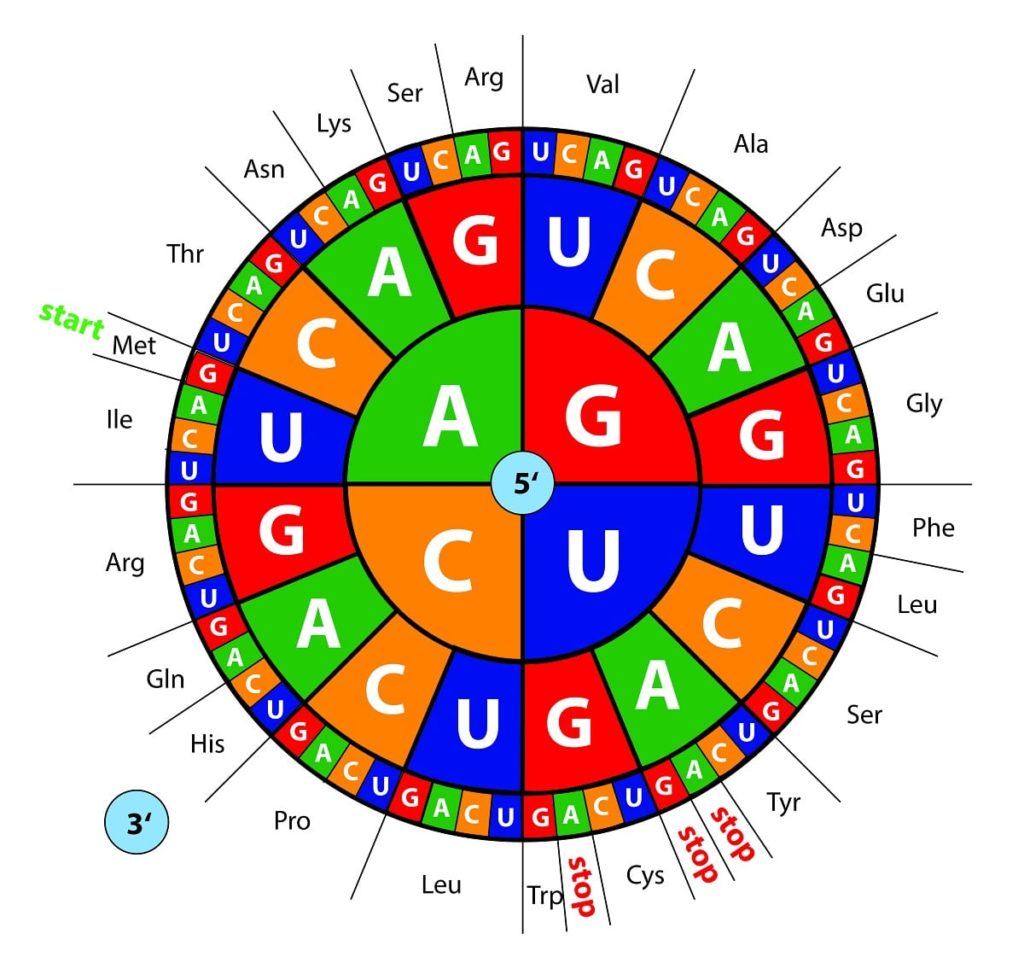
Las bases del ADN, transcritas como ARN, son “leídas” por los ribosomas en tríos o tripletes llamados codones, cada uno de los cuales codifica para uno de los 20 aminoácidos con los que se forman las proteínas; he aquí que este código genético es interpretado para introducir, en el orden correcto, un aminoácido a la vez.
Las modificaciones postraduccionales
La mayor parte de las características fisicoquímicas y funcionales de cada proteína dependen principalmente de la información codificada en el ADN.
No obstante, las células consiguen incrementar considerablemente la diversidad de sus proteínas a través de las modificaciones postraduccionales, que no son más que modificaciones químicas -mediadas por enzimas- que sufren algunas proteínas después de su traducción.
Por lo tanto, las características de algunas proteínas no pueden inferirse únicamente a partir de la secuencia aminoacídica que deriva de la información genética.
Estas modificaciones generalmente ocurren sobre los residuos aminoacídicos que componen a las proteínas -generalmente en sus cadenas laterales-, con algunas excepciones como la alanina, la isoleucina, la leucina, la fenilalanina y la valina.
Se han descrito más de 500 modificaciones postraduccionales, pero de estas las más conocidas y estudiadas son la fosforilación, la formación de puentes disulfuro, la metilación, la acetilación, la hidroxilación, la glicosilación, la prenilación, la ubiquitinación y la carboxilación.
Proceso de modificación postraduccional
Las modificaciones postraduccionales, como hemos comentado, son modificaciones químicas que sufren las proteínas celulares eucariotas después de que ha ocurrido su síntesis, es decir, de su traducción.
Generalmente tienen que ver con la adición de grupos químicos y/o modificación de los residuos aminoacídicos que conforman las proteínas, pero algunas modificaciones importantes también tienen que ver con el establecimiento de enlaces entre aminoácidos de una misma proteína, o también con la eliminación de aminoácidos o péptidos señales por cortes o clivajes proteolíticos.
Estas modificaciones son posibles gracias a la presencia de ciertas enzimas celulares especializadas y, además, de sustratos energéticos de pequeño tamaño -no son reacciones espontáneas- como, por ejemplo:
- El ATP (adenosina 5-fosfato)
- La acetil coenzima A (acetil Co-A)
- El NAD+ (5’-nicotinamida 5’-adenosina difosfato)
- La S-adenosil metionina (SAM)
- La uracil 5’-difosfato N-acetil glucosamina (UDP-GlcNAc)
- La uracil 5’-difosfato glucosa (UDP-glucosa)
- Entre otros
Algunas de las modificaciones postraduccionales más importantes actúan como interruptores (suiches) moleculares que activan o desactivan las funciones enzimáticas de algunas proteínas, regulando su función celular o incluso su ubicación intracelular.
Por ejemplo, muchas proteínas pertenecientes a los orgánulos intracelulares son sintetizadas en el citosol con extremos N- o C-terminales que corresponden a secuencias señalizadoras, las cuales son reconocidas por otras proteínas encargadas de dirigirlas al compartimiento adecuado y, en el camino, usualmente estas secuencias señales son eliminadas de la estructura proteica.
Otro ejemplo muy llamativo de modificaciones postraduccionales que tiene que ver con el clivaje proteolítico es el de ciertas hormonas y enzimas con actividad proteasa, las cuales son sintetizadas como proteínas inactivas que necesitan la remoción proteolítica de algunos de sus aminoácidos para convertirse en sus formas activas.
Proteínas conjugadas
Aunque no siempre se reconocen como tales, otras modificaciones postraduccionales muy importantes son aquellas que implican la formación de las proteínas cuya estructura está compuesta por una o más cadenas peptídicas asociadas con un compuesto no proteico, bien sea a través de enlaces covalentes o interacciones más débiles y transitorias.
Generalmente estas proteínas son clasificadas de acuerdo con la identidad de la fracción no proteica y requieren de dichas porciones para llevar a cabo sus funciones.
Estas fracciones o porciones se conocen como grupos prostéticos y un buen ejemplo de estas proteínas es la hemoglobina, que está acoplada con un grupo hemo.
Retículo endoplásmico en acción
Muchas modificaciones postraduccionales comienzan en el interior del retículo endoplásmico rugoso, donde los ribosomas asociados traducen las proteínas a medida que las insertan en la membrana de este orgánulo.
En el retículo endoplásmico muchas proteínas adquieren su conformación estructural final: sus secuencias señalizadoras son removidas, se pliegan en la forma adecuada, se forman puentes disulfuro, se añaden grupos azucarados, etc.
Tipos de modificaciones postraduccionales
Se han descrito más de 500 tipos de modificaciones postraduccionales distintas en las células eucariotas; la siguiente lista agrupa algunas de las más estudiadas:
Fosforilación
Transferencia de uno o más grupos fosfato desde moléculas de alta energía, como el ATP, hacia el grupo hidroxilo de aminoácidos como la serina, la treonina y la tirosina; es mediada por las enzimas del grupo de las proteínas quinasas (estos fosfatos son removidos por enzimas fosfatasas).
Es importante en numerosos eventos celulares como la división, la transducción de señales, el metabolismo de carbohidratos, el crecimiento celular y el progreso del ciclo celular, entre otros.
Sulfonación
Se trata de la adición de un grupo -SO3H (sulfónico) exclusivamente en los residuos del aminoácido tirosina y es típico de proteínas transmembranales o proteínas que son excretadas. Es catalizada por enzimas tirosil-sulfotransferasas.
Es un proceso importante para el funcionamiento de muchos receptores membranales, para ciertos tipos de señalización intracelulares, etc.
Formación de puentes disulfuro entre cisteínas
Este proceso se da entre residuos de cisteína y es una de las modificaciones postraduccionales más importantes desde el punto de vista estructural. Los puentes disulfuro son establecidos en orgánulos como el complejo de Golgi y el retículo endoplásmico, que tienen ambientes oxidantes.
Esta modificación postraduccional tiene que ver con el establecimiento de una determinada configuración estructural que suele ser muy importante para la actividad de numerosas enzimas.
Metilación
Consiste en la adición de grupos metilo en aminoácidos como la lisina, la arginina, la histidina, la glutamina y la asparagina (N-metilación), como el aspartato y el glutamato (O-metilación) o como la cisteína (S-metilación).
Se produce gracias a la acción catalítica de enzimas conocidas como N-, O- o S-metiltransferasas. La metilación de proteínas es fundamental para la regulación de la transcripción genética a nivel de las proteínas histonas, pero también tiene un papel menor en la transducción de señales.
Acetilación
Implica la adición de grupos acetilo a residuos de lisina de algunas proteínas. Es catalizada por enzimas acetiltransferasas y también tiene funciones muy importantes desde el punto de vista de la regulación de la expresión genética (a nivel de las proteínas histonas, que se unen al ADN).
Hidroxilación
Generalmente ocurre en residuos de prolina, lisina y asparagina y es catalizada por enzimas hidroxilasas hierro-dependientes. Los aminoácidos resultantes, hidroxiprolina e hidroxilisina, son muy importantes para la maduración de algunas proteínas (entre ellas el colágeno) y para algunos compuestos antibióticos y antifúngicos (hidroxiasparagina).
Glicosilación
Esta modificación es un proceso muy importante para las células eucariotas. Ocurre primordialmente sobre residuos de serina y asparagina, pero también puede darse sobre hidroxiprolinas o hidroxilisinas.
Consiste en la adición de moléculas carbohidratadas a la estructura proteica y es catalizada por enzimas glicosiltransferasas y se da especialmente en las proteínas de excreción y en las que se encuentran en la superficie celular.
Prenilación
Consiste en la transferencia de grupos isoprenilos (lípidos) a algunas proteínas. Las enzimas encargadas son transferasas específicas para cada grupo.
Este proceso es importante para el anclaje de algunas proteínas a las membranas celulares, pero también ocurre durante la transducción de señales, etc.
Ubiquitinación
Se trata de la adición covalente de una o varias copias del péptido conocido como ubiquitina. Esta adición marca a las proteínas para su degradación en un complejo proteico conocido como el proteosoma 26S.
Representa un sistema de regulación intracelular muy eficiente, y se encarga de destruir proteínas a través de una ruta ATP-dependiente y con la participación de tres enzimas diferentes llamadas E1, E2 y E3.
Ejemplos
La fosforilación y la glicosilación son dos modificaciones postraduccionales sumamente importantes para la vida celular. No solo porque controlan muchos procesos relacionados con la comunicación y el ciclo celular, sino también porque son muy comunes entre los eucariotas.
La proteína p53, por ejemplo, es una proteína conocida como “supresora de tumores” que es empleada durante algunos tratamientos de cáncer. Su activación depende de la acción de distintas proteínas quinasas que se encargan de la fosforilación de su extremo N-terminal.
Por otra parte, la superficie celular eucariota contiene gran cantidad de glicoproteínas (proteínas modificadas postraduccionalmente por la adición de glúcidos).
Muchas de estas proteínas tienen importantes funciones en el reconocimiento inmune, en la migración celular, en el reconocimiento y la unión a receptores, entre otras.
Referencias
- Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M., … & Walter, P. (2015). Essential cell biology. Garland Science.
- Cox, M. M., & Nelson, D. L. (2008). Lehninger principles of biochemistry. Wh Freeman.
- Garrett, R. H., & Grisham, C. M. (1999). Biochemistry.
- Green, K. D., & Garneau-Tsodikova, S. (2010). Posttranslational Modification of Proteins.
- Walsh, C. T., Garneau‐Tsodikova, S., & Gatto Jr, G. J. (2005). Protein posttranslational modifications: the chemistry of proteome diversifications. Angewandte Chemie International Edition, 44(45), 7342-7372.
