Fosfato de magnesio (Mg3(PO4)2): estructura, propiedades, usos
¿Qué es el fosfato de magnesio?
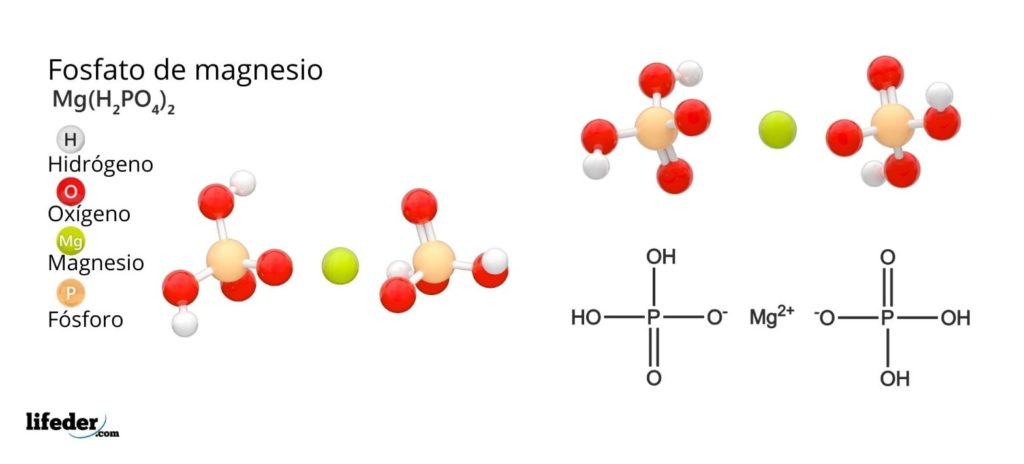
El fosfato de magnesio es un término que se usa para referirse a una familia de compuestos inorgánicos formados por magnesio, metal alcalinotérreo y el oxoanión fosfato. El fosfato de magnesio más simple tiene por fórmula química Mg3(PO4)2. La fórmula indica que por cada dos aniones PO43– hay tres cationes Mg2+ interaccionando con estos.
Asimismo, estos compuestos pueden describirse como sales de magnesio derivadas del ácido ortofosfórico (H3PO4). En otras palabras, el magnesio se “colea” entre los aniones fosfatos, sin importar su presentación inorgánica u orgánica (MgO, Mg(NO3)2, MgCl2, Mg(OH)2, etc.).
Debido a estas razones los fosfatos de magnesio pueden encontrarse como varios minerales. Algunos de estos son: catteita —Mg3(PO4)2 ·22H2O—, estruvita —(NH4)MgPO4·6H2O, cuyos microcristales son representados en la imagen superior—, holtedalita —Mg2(PO4)(OH)— y bobierrita —Mg3(PO4)2·8H2O—.
Para el caso de la bobierrita, su estructura cristalina es monoclínica, con agregados cristalinos con formas de abanicos y rosetas masivos. Sin embargo, los fosfatos de magnesio se caracterizan por exhibir una rica química estructural, significando que sus iones adoptan muchos arreglos cristalinos.
Formas del fosfato de magnesio y la neutralidad de sus cargas
Los fosfatos de magnesio derivan de la sustitución de los protones del H3PO4. Cuando el ácido ortofosfórico pierde un protón, queda como el ion dihidrógeno fosfato, H2PO4–.
¿Cómo neutralizar la carga negativa para originar una sal de magnesio? Si Mg2+ cuenta por dos cargas positivas, necesita entonces dos H2PO4–. Así, se obtiene el fosfato diácido de magnesio, Mg(H2PO4)2.
Seguidamente, cuando el ácido pierde dos protones, queda el ion hidrógenofosfato, HPO42–. Ahora, ¿cómo neutralizar estas dos cargas negativas? Como el Mg2+ solo necesita dos cargas negativas para neutralizarse, interacciona con un solo ion HPO42–. De esta manera se obtiene el fosfato ácido de magnesio: MgHPO4.
Finalmente, cuando todos los protones se pierden, queda el anión fosfato PO43–. Este requiere de tres cationes Mg2+ y de otro fosfato para ensamblarse en un sólido cristalino. La ecuación matemática 2(-3) + 3(+2) = 0 ayuda a entender estas proporciones estequiométricas para el magnesio y el fosfato.
Como resultado de estas interacciones, se produce el fosfato de magnesio tribásico: Mg3(PO4)2. ¿Por qué es tribásico? Porque es capaz de aceptar tres equivalentes de H+ para formar nuevamente el H3PO4:
PO43–(ac) + 3H+(ac) => H3PO4(ac)
Fosfatos de magnesio con otros cationes
La compensación de las cargas negativas también puede lograrse con la participación de otras especies positivas.
Por ejemplo, para neutralizar el PO43–, los iones K+, Na+, Rb+, NH4+, etc., también pueden interceder, formando el compuesto (X)MgPO4. Si X es igual a NH4+, se forma el mineral estruvita anhidro, (NH4)MgPO4.
Dada la situación de que intervenga otro fosfato y aumenten las cargas negativas, otros cationes adicionales pueden sumarse a las interacciones para neutralizarlas. Gracias a esto, numerosos cristales de fosfato de magnesio pueden sintetizarse (Na3RbMg7(PO4)6, por ejemplo).
Estructura
La imagen superior ilustra las interacciones entre los iones Mg2+ y PO43– que definen la estructura cristalina. No obstante, es solo una imagen que demuestra más bien la geometría tetraédrica de los fosfatos. Entonces, la estructura cristalina implica tetraedros de fosfatos y esferas de magnesio.
Para el caso del Mg3(PO4)2 anhidro, los iones adoptan una estructura romboédrica, en la cual el Mg2+ está coordinado con seis átomos de O.
Lo anterior es ilustrado en la imagen inferior, con la acotación de que las esferas azules son de cobalto, bastando con cambiarlas por las esferas verdes de magnesio:
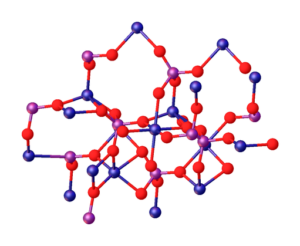
Justo en el centro de la estructura puede ubicarse el octaedro formado por las seis esferas rojas en torno de la esfera azulada.
Asimismo, estas estructuras cristalinas son capaces de aceptar moléculas de agua, formando hidratos de fosfato de magnesio.
Esto es debido a que estas forman puentes de hidrógeno con los iones fosfatos (HOH—O-PO33–). Además, cada ion fosfato es capaz de aceptar hasta cuatro puentes de hidrógeno; es decir, cuatro moléculas de agua.
Como el Mg3(PO4)2 tiene dos fosfatos, puede aceptar ocho moléculas de agua (lo que ocurre con el mineral bobierrita). A su vez, estas moléculas de agua pueden formar puentes de hidrógeno con otras o interaccionar con los centros positivos de Mg2+.
Propiedades
Es un sólido blanco, formando placas rómbicas cristalinas. Asimismo, no tiene olor y tampoco sabor.
Es muy insoluble en agua, incluso cuando está caliente, debido a su gran energía de red cristalina; esto es producto de las fuertes interacciones electrostáticas entre los iones polivalentes Mg2+ y PO43–.
Es decir, cuando los iones son polivalentes y sus radios iónicos no varían mucho en tamaño, el sólido muestra resistencia a su disolución.
Funde a 1184 ºC, lo que también es indicativo de las fuertes interacciones electrostáticas. Estas propiedades varían en función de cuántas moléculas de agua absorba, y si el fosfato se encuentra en algunas de sus formas protonadas (HPO42– o H2PO4–).
Usos/aplicaciones
Laxante
Se ha usado como laxante para los estados de constipación y acidez gástrica. Sin embargo, sus efectos secundarios dañinos —manifestados por la generación de diarrea y vómitos— han limitado sus usos. Además, es probable que produzca daños en el tracto gastrointestinal.
Reparación de huesos
Actualmente se está explorando el uso del fosfato de magnesio en la reparación del tejido óseo, investigándose la aplicación del Mg(H2PO4)2 como cemento.
Esta forma del fosfato de magnesio cumple con los requisitos para ello: es biodegradable e histocompatible. Además, su uso en la regeneración del tejido óseo es recomendado por su resistencia y fraguado rápido.
Material para ortopedia
Se está evaluando el uso del fosfato de magnesio amorfo (AMP) como cemento ortopédico biodegradable y no exotérmico. Para generar este cemento se mezcla el polvo de AMP con alcohol polivinílico, para así formar una masilla.
En los seres vivos
La función principal del fosfato de magnesio es servir de aporte de Mg a los seres vivos. Este elemento interviene en numerosas reacciones enzimáticas como catalizador o intermediario, siendo imprescindible para la vida.
Una deficiencia de Mg en los seres humanos se asocia a los siguientes efectos: disminución de los niveles de Ca, falla cardíaca, retención de Na, disminución de los niveles de K, arritmias, contracciones musculares sostenidas, vómitos, náuseas, bajos niveles circulantes de la hormona paratiroidea y calambres estomacales y menstruales, entre otros.
Referencias
- Mineral Data Publishing. (2001-2005). Bobierrite. Recuperado de handbookofmineralogy.org
- Sahar Mousa. (2010). Study on synthesis of magnesium phosphate materials. Phosphorus research bulletin Vol. 24, pp 16-21.
- Wikipedia. (2018). Magnesium phosphate tribasic. Recuperado de en.wikipedia.org
- Pubchem. (2018). Magnesium Phosphate Anhydrous. Recuperado de pubchem.ncbi.nlm.nih.gov
- Barbie, E., Lin,B., Goel,V.K. y Bhaduri, S. (2016) Evaluation of amorphous magnesium phosphate (AMP) based non-exothermic ortopedic cement. Biomedical Mat. Volumen 11(5): 055010.
- Yu, Y., Yu, CH. y Dai, H. (2016). Preparation of a degradable magnesium bone cement. Regenerative Biomaterials. Volumen 4(1): 231
