Precipitación química: concepto, proceso, tipos, ejemplos

¿Qué es la precipitación química?
La precipitación química es un proceso de tratamiento de aguas residuales en el que se agregan sustancias químicas para transformar iones contaminantes disueltos en partículas sólidas. Dicho de otra forma, consiste en generar partículas sedimentables en las aguas residuales por la adición de sustancias químicas.
El principal objetivo de la precipitación química es eliminar iones contaminantes tales como cationes de metales pesados por la adición de contraiones (iones de carga opuesta) que forman compuestos menos solubles con dichos metales.
Aunque la mayor parte de los contaminantes que se busca eliminar son metales tales como cobalto, cesio o mercurio que forman cationes (iones con carga positiva), también se usa para eliminar aniones (iones con carga negativa) tales como el fluoruro, el cianuro y el fosfato.
Una vez el sólido precipita, es necesario llevar a cabo una serie de pasos para poder separar el mismo del resto del agua. Estos pasos incluyen la floculación, la sedimentación y la separación sólido-líquido.
El equilibrio de solubilidad y la precipitación química
La técnica de la precipitación química se fundamenta en el equilibrio de solubilidad de los compuestos iónicos y en la constante del producto de solubilidad. En la mayoría de los casos, los sólidos que se precipitan son hidróxidos poco solubles, aunque también se precipitan otros tipos de iones.
En todos los casos de precipitación química, el sólido que se forma es un compuesto iónico poco soluble que está en equilibrio con los iones en solución según la reacción general:
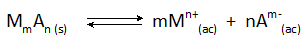
La concentración final del metal, M, que queda en la solución viene determinada por la constante de equilibrio de esta reacción, así como por la concentración del anión, A, que se añade.
Por ejemplo, si se trata de un hidróxido, la concentración final del metal dependerá de la concentración de iones hidróxido en la solución y, por lo tanto, del pH.
Proceso de precipitación química paso a paso
El proceso de precipitación química consiste en cuatro pasos básicos:
Paso 1: Adición del agente precipitante y ajuste de pH.
Esta es la etapa inicial en la cual se agrega el agente precipitante que se haya seleccionado (en la mayoría de los casos es hidróxido de calcio). El pH se ajusta para maximizar la precipitación y optimizar la pureza final del agua.
Durante este paso, normalmente se bate o agita la mezcla enérgicamente para asegurar una concentración de precipitante uniforme.
Paso 2: Floculación.
Esta etapa consiste en permitir que los pequeños sólidos que se van formando en la primera etapa de la precipitación se unan entre sí formando partículas o “flóculos” más grandes (de allí su nombre).
Estos sedimentarán más rápidamente en el siguiente paso. Para favorecer la formación de estas partículas sin romperlas, la agitación se hace más lentamente.
Paso 3: Sedimentación.
Consiste en dejar reposar la mezcla de agua recién tratada en un tanque para dejar que todas las partículas sólidas se vayan al fondo (sedimenten).
Paso 4: Separación sólido-líquido.
En la mayoría de los casos, la separación sólido-líquido consiste en una simple decantación del agua que queda encima del sedimento. En otros casos, la separación se logra filtrando o incluso centrifugando el agua tratada, dependiendo de qué tan peligrosos sean los contaminantes.
Tipos de precipitación química
Precipitación de hidróxidos
Este es el tipo de precipitación química más común y consiste en aumentar el pH añadiendo un compuesto alcalino que casi siempre es hidróxido de calcio (Ca(OH)2).
La reacción química que ocurre es:

En la reacción anterior, M representa un catión cualquiera del metal que se desea eliminar. El sólido que se forma en este caso es un hidróxido muy poco soluble.
En el caso de la precipitación de hidróxidos, la regla general es que mientras mayor sea la concentración de OH– (mientras mayor sea el pH), menor será la concentración del metal que queda en el agua, luego de tratada. En otras palabras, a mayor pH, mayor pureza final del agua.
Precipitación con sulfuros
Este tipo de precipitación química se utiliza principalmente para la eliminación de metales pesados, como el plomo o el mercurio, en forma de sulfuros muy poco solubles. Para lograrlo, se puede añadir al agua a tratar tanto sulfuros solubles como insolubles.
Los sulfuros más comúnmente usados son los solubles que incluyen al sulfuro de hidrógeno (H2S) y al sulfuro de sodio (Na2S). La reacción general de precipitación es:
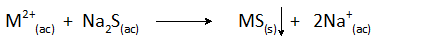
También se puede agregar sulfuro ferroso el cual es insoluble, pero aporta suficientes iones sulfuro a la solución para precipitar a la mayoría de metales pesados.
Precipitación de carbonatos
Los carbonatos de muchos metales son menos solubles incluso que los hidróxidos y se pueden precipitar de las aguas residuales añadiendo carbonato de calcio, o convirtiendo los hidróxidos en carbonatos burbujeando dióxido de carbono en la mezcla alcalinizada.
Precipitación de cianuro
A diferencia de los casos anteriores, aquí se busca precipitar al cianuro, que es un anión, en lugar de a un metal. El cianuro es un contaminante venenoso muy peligroso y se puede eliminar de las aguas residuales añadiendo sulfato de cinc o sulfato ferroso, ya que forma complejos con estos metales que precipitan.
Coprecipitación
La coprecipitación ocurre cuando un soluto precipita junto con otro. En estos casos, el primer soluto queda atrapado en el sólido cuando se forma un precipitado de otro compuesto.
Es como si el sólido al formarse dejara enjaulado al primer soluto y lo arrastrara fuera de la solución. Este fenómeno se aprovecha para eliminar algunos contaminantes que son difíciles de precipitar por sí solos.
Aplicaciones
La precipitación química se utiliza en un sinfín de industrias con la finalidad de cumplir con los requerimientos ambientales de calidad de aguas residuales.
La precipitación de hidróxidos se utiliza en las industrias de:
- Acabados metálicos
- Manufactura de compuestos inorgánicos
- Fundiciones
- Manufactura de fuegos artificiales y explosivos
- Esmaltado de porcelanas
- Minería de carbón
- La industria farmacéutica, entre otras.
Por otro lado, la precipitación con sulfuros se utiliza en la industria para eliminar contaminantes como mercurio, plomo y plata. Esto tiene aplicación en las siguientes industrias:
- Industria Textil
- Minería
- Equipos y suministros fotográficos
- Manufactura de metales no ferrosos, entre otras
Además de estas industrias, la precipitación es la técnica más importante para la purificación del agua de enfriamiento de los reactores nucleares. En dicha industria, se utiliza para eliminar cationes radiactivos tales como plutonio, américo, cesio y otros.
Ejemplos de precipitación química
Precipitación de estroncio con carbonato de calcio
La reacción de precipitación en este caso es:

La reacción se lleva a cabo a un pH óptimo de 10,5 y logra concentraciones de este metal hasta 100 veces menores que la inicial.
Precipitación de hidróxido de antimonio
Para eliminar el antimonio de las aguas residuales, se puede utilizar el hidróxido de titanio como reactivo precipitante. La reacción es:

Ésta se lleva a cabo en un rango de pH que va de 5 a 8,5 y también logra reducir la concentración a un valor 100 veces menor que el inicial.
Precipitación de cesio con tetrafenilborato
Este es un caso especial que permite la precipitación del cesio, un metal alcalino difícil de precipitar. La reacción es:

Utilizar tetrafenilborato trae dos grandes beneficios: primero, que funciona prácticamente a cualquier pH (desde pH 1 hasta 13) y segundo, que la baja solubilidad de la sal que se forma permite reducir la concentración final del contaminante por un factor de mil.
Precipitación de cobre con sulfuro de sodio
La reacción de precipitación en este caso es:
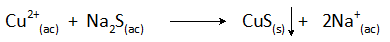
La remoción de cobre de aguas residuales por este método se lleva a cabo a valores de pH superiores a 8 y se reduce su concentración en más del 99%.
Coprecipitación de cromo, plomo y cinc con hidróxido férrico e hidróxido de aluminio
En este caso, se añade hidróxido de sodio al agua para precipitar el hierro y el aluminio que está presente en forma de hidróxido férrico (Fe(OH)3) e hidróxido de aluminio (Al(OH)3). Cuando estos dos hidróxidos precipitan, arrastran parte de los iones de cromo, plomo y cinc. El tratamiento posterior con sulfuro de hidrógeno remueve casi la totalidad de estos tres metales.
Referencias
- Wang, L. K., Vaccari, D. A., Li, Y., & Shammas, N. K. (2005). Chemical Precipitation. Physicochemical Treatment Processes, 141–197. doi:10.1385/1-59259-820-x:141
- Striebig, B.A. (2005). Chemical Precipitation. In Water Encyclopedia (eds. J.H. Lehr and J. Keeley). https://doi.org/10.1002/047147844X.pc101
- Britannica, T. Editores de Encyclopaedia (2018, February 8). Chemical precipitation. Encyclopedia Britannica. https://www.britannica.com/science/chemical-precipitation
- D. Bhattacharyya, A. B. Jumawan Jr. & R. B. Grieves(1979)Separation of Toxic Heavy Metals by Sulfide Precipitation, Separation Science and Technology, 14:5, 441-452, DOI: 10.1080/01496397908058096
- Marina Maya Marchioretto, Harry Bruning & Wim Rulkens (2005) Heavy Metals Precipitation in Sewage Sludge, Separation Science and Technology, 40:16, 3393-3405, DOI: 10.1080/01496390500423748
