Óxido de aluminio: estructura, propiedades, usos, nomenclatura
El óxido de aluminio, también llamado alúmina, óxido alumínico, corindón o trióxido de aluminio, es un compuesto inorgánico cuya fórmula química es Al2O3. Se trata de un óxido anfótero, aunque puede llegar a ser, debido al tratamiento, un compuesto casi inerte.
Posee una gran dureza, resistencia a la corrosión y alta resistencia eléctrica. Estas propiedades, entre otras, ha permitido que el óxido de aluminio tenga numerosas aplicaciones, tales como: aislamiento eléctrico, material abrasivo, implantes de huesos y dientes, etc.
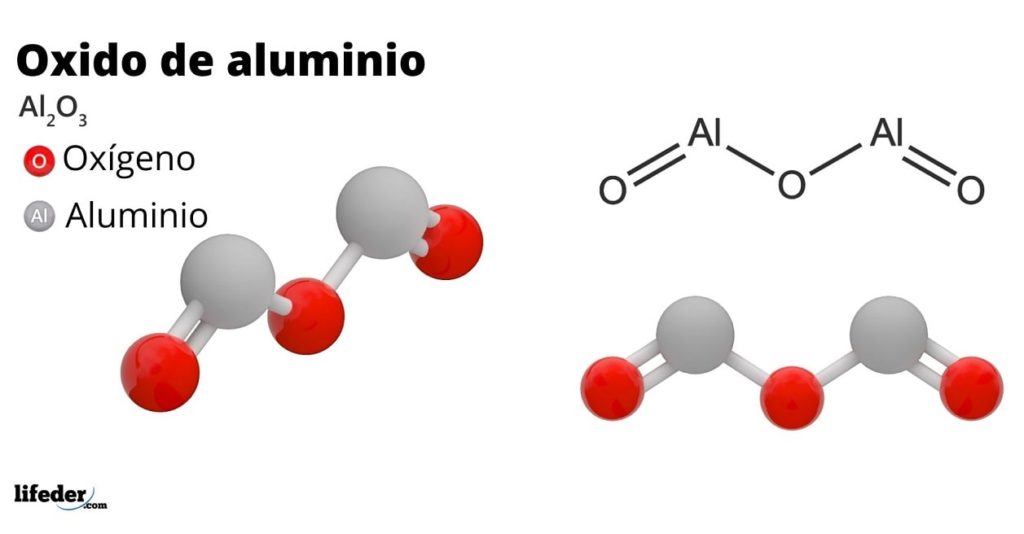
La bauxita es la fuente principal para la obtención del óxido de aluminio. El corindón, por otro lado, es un mineral del óxido de aluminio que se encuentra en estado libre bajo la forma de α-Al2O3. El corindón posee una dureza de 9.0, y debido a algunas impurezas, produce piedras preciosas, tales como el zafiro y el rubí.
La electrólisis del óxido de aluminio sirvió de base para el aislamiento del aluminio por Humphry Davy en 1808. Este mismo método, con algunas adaptaciones, se utiliza actualmente en la producción de aluminio metálico.
Índice del artículo
- 1 Estructura
- 2 Propiedades del óxido de aluminio
- 3 Nomenclatura
- 4 Usos/aplicaciones
- 5 Obtención
- 6 Referencias
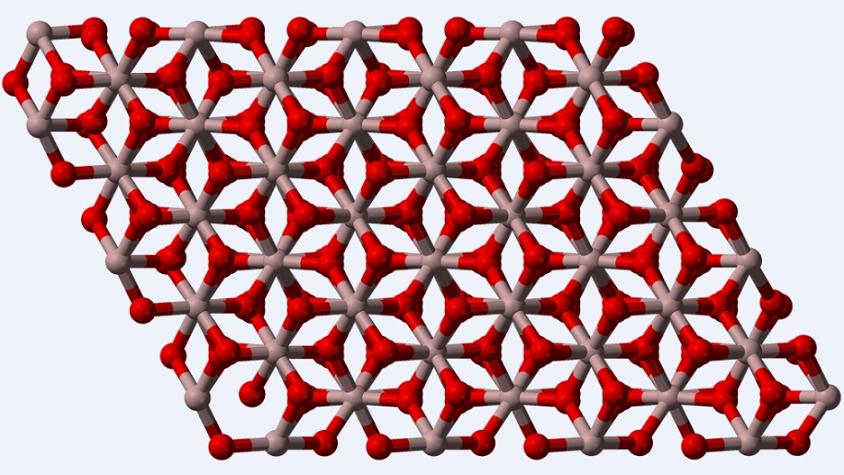
El corindón o la fase α-Al2O3, por ser el polimorfo termodinámicamente más estable para el óxido de aluminio, su estructura (imagen superior) se considera como la principal al momento de su caracterización. Esta estructura es trigonal, con los iones Al3+ rodeados por seis O2-, y por lo tanto, estableciendo octaedros AlO6 con interacciones Al—O u Al-O.
Además del corindón, el Al2O3 también existe como otros polimorfos metaestables, entre ellos: γ-Al2O3 y η-Al2O3 (cúbicos), θ-Al2O3 (monoclínico), Χ-Al2O3 (hexagonal), κ-Al2O3 (ortorrómbico) y δ-Al2O3 (tetragonal u ortorrómbico).
A medida que se calienta el Al2O3, los octaedros se van “rompiendo” en tetraedros AlO4 o pentaedros AlO5. Una vez fundido, y vuelto a enfriar, se puede obtener un óxido de aluminio vítreo, es decir, amorfo, con mezclas de poliedros AlO5 y AlO6.

Sólido o polvo blanco cristalino
101.96 g/mol
Inodoro
3.798 g/cm3
2072 ºC
2977 ºC
Insoluble en todos los disolventes, incluyendo el agua.
30 W·m-1·K-1. A pesar de su uso en cerámica, tiene una conductividad térmica relativamente alta.
1.768-1.760
Es un compuesto que presenta una dureza muy alta, con un valor de 9.0 en la escala de dureza Mohs bajo la forma de α-óxido de aluminio (corindón).
A 300 ºC: 1.2 x 1013 ohmios·cm. El óxido de aluminio o alúmina es por lo tanto un aislante eléctrico.
El Al2O3 a pesar de reaccionar débilmente con los álcalis, y en mayor grado con los ácidos, es considerado un anfótero químico. Sin embargo, cuando es calentado a más de 800 ºC, adquiere un estado casi inerte a la acción de los ácidos.
Este óxido es el responsable de proteger al aluminio frente a los agentes corrosivos ambientales, pues recubre firmemente la superficie del metal sin desmenuzarse o agrietarse.
La nomenclatura del Al2O3 es simple. Sistemáticamente se conoce como trióxido de dialuminio. Como solo existe este óxido para el aluminio, en su nomenclatura stock no se especifica la valencia del metal (III). Asimismo, tradicionalmente su nombre se resume a óxido alumínico, por tener una sola valencia.
El óxido de aluminio interviene en la elaboración del vidrio aluminio-silicato. Este vidrio refractario, resistente al choque térmico, puede usarse a temperaturas más elevadas que el vidrio boro-silicato; aunque presenta menor resistencia química.
La adición de una pequeña cantidad de magnesia transforma el vidrio opaco de alúmina en translúcido, pudiéndose usar como recipiente de gases en los bombillos de vapor de sodio a alta presión. También se usa en la preparación de suspensiones de revestimiento de ciertos tipos de lámparas fluorescentes.
La alúmina activada tiene una característica granular y porosa que puede tener actividad catalítica, o servir de soporte para la actividad de otros catalizadores. Entre otros procesos, la alúmina interviene en la catálisis de la polimerización del óxido de etileno.
Las nano-partículas de óxido de aluminio se adhieren a la superficie de las bacterias, provocando su muerte. Asimismo, se ha evidenciado un efecto similar sobre el hongo del género Candida.
El óxido de aluminio tiene una resistividad eléctrica alta, lo cual le confiere la capacidad de actuar como aislante eléctrico. Por lo tanto es usado en paquetes de circuitos integrados. También se usa en dispositivos superconductores, y como dieléctrico de condensadores o capacitores. Además, se usa como aislante en las bujías eléctricas.

La alta dureza del mineral corindón permite que se utilice como un abrasivo, de menor costo que los diamantes, en la industria y en la perforación petrolera.
El corindón adquiere la forma de piedra preciosa, como el rubí de color rojo, a causa de una contaminación con cromo; o como el zafiro de color azul, debido a una contaminación con hierro y titanio. Muchos tipos del papel de lija empleado en metal y en madera poseen cristales de óxido de aluminio.
La tenacidad o capacidad para evitar la ruptura del óxido de aluminio aumenta con la adición de zirconia o de carburo de silicio, lo que lo capacita para ser utilizado en las herramientas industriales de corte. Además, el óxido de aluminio se usa en cremas dentales para el pulido de los dientes.
También algunas presentaciones del óxido de aluminio son utilizadas como abrasivos por los dermatólogos en el tratamiento de ciertas afecciones de la piel.
El óxido de aluminio es un compuesto con avidez por el agua, por lo que puede ser usado para extraerla de corrientes gaseosas.
Las nano-partículas de hidróxido de óxido de aluminio (bohemita) actúan como un disipador del calor, liberando agua y retardando la aparición de las llamas.
El óxido de aluminio es un compuesto de gran dureza, químicamente inerte y resistente a la corrosión, además de tener un color blanco. Por estas cualidades se usa como sustituto de tejidos duros como los huesos y los dientes. Asimismo, se ha usado el material construido con el óxido de aluminio en el reemplazo de articulaciones.

La bauxita es el principal mineral para la obtención de óxido de aluminio, estando formado por la mezcla de tres minerales: la gibbsita, la laboehmita y la diáspora.
El óxido de aluminio es extraído de sus minerales por el procedimiento de Bayer. Este consiste en la reacción en caliente de la bauxita con el hidróxido de sodio, reacción que produce el aluminato de sodio [NaAl(OH)4].
Cuando la solución anterior es enfriada, se produce la precipitación del hidróxido de aluminio en forma sólida. Luego este hidróxido se calienta hasta los 1100 ºC, produciéndose el óxido de aluminio.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Aluminium oxide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Aluminum oxide. PubChem Compound Summary for CID 9989226. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Kushagri S. et al. (2019). Antiviral and Antimicrobial Potentiality of Nano Drugs: Aluminium Oxide Nanoparticles. Recuperado de: sciencedirect.com
- The Editors of Encyclopaedia Britannica. (2020). Alumina. Recuperado de: britannica.com
- Lohninger Hans. (15 de agosto de 2020). Aluminum Oxide. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
