Agar bilis esculina: fundamento, preparación y usos
El agar bilis esculina es un medio de cultivo sólido selectivo y diferencial. Es utilizado como prueba diagnóstica para determinar la capacidad que posee un determinado microorganismo de crecer en un medio que contiene bilis y además descomponer el glucósido esculina en esculetina y glucosa.
Esta prueba diagnóstica se usa para diferenciar especies del género Streptococcus pertenecientes al grupo D (bilis esculina positiva), de otros grupos de Streptococcus que reaccionan negativamente frente a esta prueba.
Cabe destacar que algunos Streptococcus del grupo viridans pueden hidrolizar la esculina, pero no son capaces de crecer en presencia de bilis a una concentración de 40%, por tanto, en este medio la reacción para este grupo es negativa.
Por otra parte, el medio bilis esculina también es útil para el diagnóstico de Listeria monocytogenes o de especies de Aerococcus sp, ya que estos microorganismos son bilis esculina positiva.
El agar bilis esculina está compuesto por peptona, extracto de carne, bilis de buey, esculina, citrato de hierro, agar y agua destilada. Algunas casas comerciales incluyen azida sódica dentro de la composición del medio.
El medio puede ser preparado en el laboratorio si se tienen todos los compuestos por separado o puede prepararse a partir del medio deshidratado comercial.
Índice del artículo
El medio bilis esculina contiene peptonas y extracto de carne, ambos compuestos proporcionan las sustancias nutritivas necesarias para el crecimiento de los microorganismos.
También contiene esculina; este compuesto es un glucósido formado por la unión de un monosacárido simple (glucosa) con un compuesto denominado 6,7-dihidroxicumarina o esculetina (aglucona), unido por un enlace acetal o glucosídico.
La prueba se basa en demostrar si la bacteria es capaz de hidrolizar a la esculina. Si esto ocurre la esculina se descompone en esculetina y glucosa. La esculetina reacciona con el hierro presente en el medio, formando un compuesto marrón oscuro, casi negro.
Esto quiere decir que el citrato férrico actúa como un revelador de la reacción. Esta característica hace que el agar bilis esculina sea un medio diferencial.
Por su parte, la bilis es un inhibidor que impide el crecimiento de algunos microorganismos, por tanto, la bacteria antes de desdoblar la esculina tiene que ser capaz de crecer en presencia de la bilis. Por ello, este medio se considera selectivo.
Las bacterias que pueden desarrollarse en este ambiente son principalmente aquellas que viven en el ambiente intestinal.
En este sentido, algunas casas comerciales adicionan al medio azida sódica para inhibir adicionalmente el crecimiento de bacilos Gram negativos entéricos, aumentando la selectividad del medio para el crecimiento de Streptococcus.
Finalmente, el agar da la consistencia sólida al medio y el agua es el disolvente de los compuestos.
Pesar:
5 g de peptonas
3 g de extracto de carne
40 g de bilis de buey
1 g de esculina
0,5 gr de citrato de hierro
15 g de agar
1000 ml de agua destilada
En caso de agregar azida sódica se pesa 0,25 gr/litro y se adiciona a la mezcla.
Disolver los componentes en el litro de agua destilada, calentar hasta disolver los compuestos en su totalidad. Distribuir 5 ml en tubos de ensayo con tapa de rosca de 16 x 125 mm. Autoclavar a 121°C, a 15 libras de presión por 15 minutos.
Sacar del autoclave e inclinar los tubos sobre un soporte, de manera que solidifique el agar en un amplio pico de flauta.
Conservar en nevera hasta su uso. Llevar a temperatura ambiente antes de sembrar.
También se pueden preparar placas de agar bilis esculina; en este caso se autoclava la totalidad de la mezcla en una fiola y posteriormente se distribuye en placas de Petri estériles. Se dejan solidificar y se guardan en nevera.
El pH del medio debe quedar en 6.6 ± 0,2.
Pesar la cantidad que especifique el inserto. Este puede variar de una casa comercial a otra. Posteriormente, proceder igual al procedimiento explicado anteriormente.
El pH del medio debe quedar en 6,6 ± 0,2. El color del medio deshidratado es beige claro y el medio preparado es ámbar oscuro.

El medio bilis esculina se usa principalmente para diferenciar los Streptococcus del Grupo D (bilis esculina positiva), del resto de los grupos de Streptococcus (bilis esculina negativa).
Si se combina la prueba de crecimiento en caldo hipersalado con la prueba de la bilis esculina se puede hacer la identificación de un grupo especial de Streptococcus del grupo D denominados Enterococcus.
Este grupo especial de Streptococcus pertenecen al grupo D del género mencionado y son capaces de hidrolizar la esculina en presencia de bilis como lo hace el resto de los miembros del grupo D, pero además son capaces de desarrollarse en un medio hipersalado (BHI con cloruro de sodio al 6,5%), propiedad que hace la diferencia.
Por tanto, los Streptococcus que hidrolizan la bilis esculina pero no crecen en caldo hipersalado se denominan Streptococcus del grupo D no enterococos.
Inocular el medio preferiblemente a partir de un caldo puro de 24 horas de Todd-Hewitt.
Agregar 2 gotas en la superficie del medio con una pipeta Pasteur y extender en el medio con un asa de platino.
Incubar a 35°C por 48 horas, mientras se cumple el tiempo de incubación se puede ir monitoreando para ver si hay reacción positiva. Si al culminar el tiempo la reacción sigue negativa se puede incubar hasta completar las 72 horas.
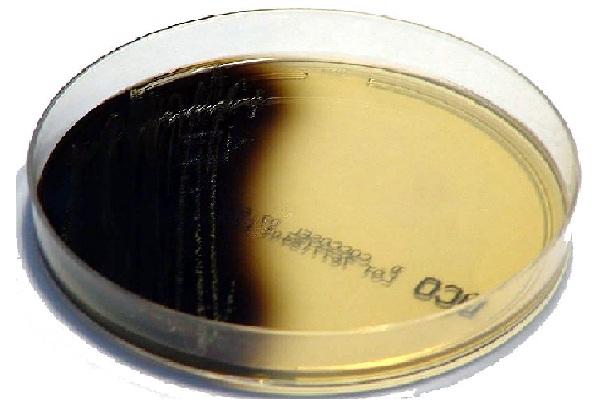
Reacción positiva: aparición de un color castaño oscuro, casi negro en el pico de flauta (en caso de la prueba en tubo) o ennegrecimiento del agar alrededor de las colonias (en caso de la prueba en placas).
Reacción negativa: no se produce ennegrecimiento del medio o existe la aparición del color negro en menos de la mitad del tubo después de 72 horas de incubación. Por otra parte, el crecimiento bacteriano en el medio sin la aparición del color negro debe considerarse una prueba negativa.
Para evaluar la calidad del medio se debe disponer de una cepa de Enterococcus faecalis ATCC 29212 como control positivo y una cepa de Streptocococus no perteneciente al grupo D como control negativo.
-Los medios que no contienen azida sódica permiten el crecimiento de bacilos Gram negativos entéricos. Alguno de ellos pueden ennegrecer el medio.
– Algunas casas comerciales adicionan bajas concentración de bilis (10%) y por esta razón algunos Streptococcus que no pertenecen al grupo D pueden desarrollarse en el medio e hidrolizar la esculina, lo que puede generar errores en la interpretación.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Mac Faddin J. (2003). Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3era ed. Editorial Panamericana. Buenos Aires. Argentina.
- Lab. Britania. Bilis esculina con azida agar. 2015. Disponible en: britanialab.com
- “Agar bilis esculina.” Wikipedia, La enciclopedia libre. 22 ago 2017, 17:30 UTC. 22 abr 2019, 17:35. es.wikipedia.org.
- Laboratorios Bd. Bile Esculin Agar Slants. 2015. Disponible en: bd.com
- Laboratorios Neogen. Agar bilis esculina. Disponible en: foodsafety.neogen.com
