Electrolitos débiles: concepto, características, ejemplos
Un electrolito débil es toda aquella sustancia que al disolverse en agua no se ioniza por completo. Esto significa que su disolución produce o libera menores cantidades de iones de lo que podría esperarse. Dicho proceso de ionización viene establecido por un equilibrio de hidrólisis, en el cual se forman iones tales como el H3O+ u OH–.
Los electrolitos débiles por lo general se tratan de compuestos covalentes, cuyas moléculas tienden a permanecer neutras sin adquirir cargas iónicas. Muchos de estos electrolitos consisten de moléculas orgánicas con grupos funcionales ionizables, aunque también las hay de tipo inorgánicas, entre ellas varios oxácidos.
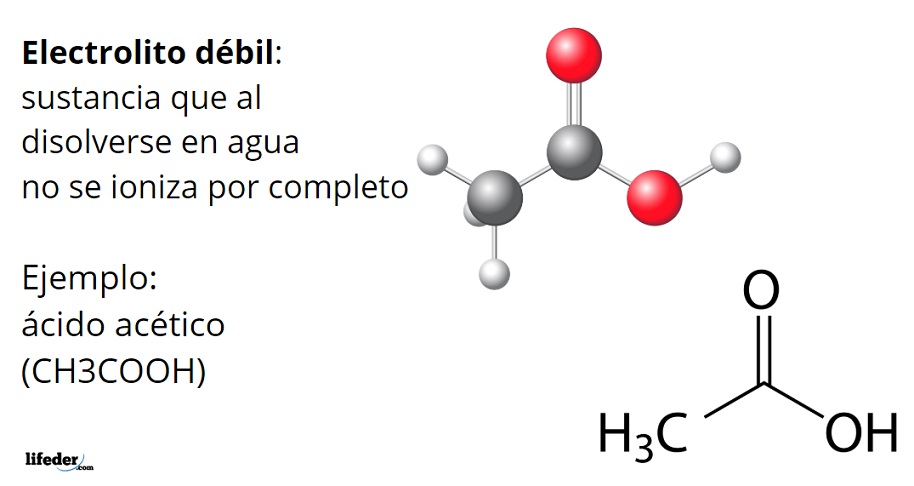
El ácido acético, CH3COOH, es un ejemplo de un electrolito débil. Su molécula posee un grupo funcional que caracteriza su acidez en el agua. Sin embargo, cuando se disuelve no todas sus moléculas producen iones H3O+ transformándose en el anión acetato, CH3COO–, sino que permanecen neutras, protonadas.
Algunos electrolitos son más débiles que otros, lo cual dependerá del grado de sus ionizaciones. Cuando se disuelven ocasionan cambios moderados en el pH. Así, tenemos electrolitos débiles ácidos o básicos.
Índice del artículo
En términos generales, los electrolitos débiles son compuestos covalentes, por lo que sus unidades constituyentes son las moléculas.
Estas moléculas tienen la capacidad de adquirir cargas iónicas. Para ello, participa en un equilibrio de hidrólisis, en el que una molécula de agua se “parte” en OH–, o acepta un hidrógeno para transformarse en H3O+.
Mientras menos probable o inestable sea la hidrólisis, menor será la cantidad o concentraciones de iones presentes en la disolución de estos electrolitos.
Las disoluciones de los electrolitos débiles no son tan buenas conductoras de la electricidad, en comparación a las de los electrolitos fuertes. Esto se debe precisamente a su menor número de iones en solución, lo cual dificulta el paso de los electrones a través del agua.

La molécula de ácido carbónico, H2CO3, al disolverse en agua sufre la siguiente reacción de hidrólisis:
H2CO3 + H2O ⇌ HCO3– + H3O+
El problema es que no todo el H2CO3 se ioniza en HCO3–. Además, el H2CO3 se desproporciona en dióxido de carbono y agua, lo cual reduce todavía más la conductividad de esta solución.
Para los restantes ejemplos se reincidirá en este hecho: una molécula, que en principio es neutra, adquiere carga iónica, y en el proceso mediado por hidrólisis se producen iones H3O+ u OH–.
La molécula de amoníaco, NH3, al disolverse en agua sufre la siguiente reacción de hidrólisis:
NH3 + H2O ⇌ NH4+ + OH–
Estas disoluciones amoniacales despiden un olor punzante.
Esta vez tenemos iones OH–. El amoníaco es una base débil, mientras que el ácido carbónico, un ácido débil. Por lo tanto, los ácidos y las bases débiles se catalogan como electrolitos débiles, ya que se ionizan parcialmente sin liberar altas concentraciones de iones H3O+ u OH–, respectivamente.
El ácido fosfórico, H3PO4, es un ejemplo de un oxoácido débil, el cual a su vez es un electrolito:
H3PO4+ H2O ⇌ H2PO4– + H3O+
El ácido fosfórico es capaz todavía de sufrir otras dos disociaciones, una por cada hidrógeno acido (tres en total). La concentración de H3O+ producido es menor si se le compara con la de un oxoácido fuerte, como el ácido nítrico, HNO3, el cual es un electrolito fuerte. Mientras más débil sea el electrolito, menos ácido o básico será.
El fluoruro de hidrógeno, HF, es un ejemplo de un compuesto inorgánico covalente que, sin ser un oxoácido, es un electrolito débil por tratarse de un ácido débil. Cuando se disuelve en agua se produce el ácido fluorhídrico, el cual se ioniza parcialmente:
HF+ H2O ⇌ F– + H3O+
A pesar de no ser un electrolito fuerte, el ácido fluorhídrico es capaz de “comerse” el vidrio de los materiales que comúnmente se utilizan para almacenar disoluciones ácidas.
La piridina, C5H5N, es una amina que se hidroliza para formar iones OH–:
C5H5N + H2O ⇌ C5H5NH + + OH–
La piridina es más básica que el amoníaco, por lo que su ionización será mayor y, por lo tanto, producirá concentraciones más grandes de iones OH–.
El ácido cianhídrico, HCN, también es otro ejemplo de un ácido y electrolito débil:
HCN + H2O ⇌ CN– + H3O+
Este punto es polémico. Hasta ahora los electrolitos débiles se han clasificado como ácidos o bases débiles, caracterizados por sus ionizaciones parciales. No obstante, las sales insolubles en agua, que de por sí ya están ionizadas en sus cristales, también se han considerado como electrolitos débiles.
Al disolverse con dificultad en el agua, la cantidad de iones que liberan en solución es pequeña cuando se comparan con la de las sales solubles. En este sentido, las sales insolubles producen disoluciones menos conductoras, lo cual las eclipsan un poco como electrolitos fuertes.
Por esta razón, aquí se asumirá que estas sales pertenecen al grupo de los electrolitos débiles, aun cuando al disolverse generen iones y no moléculas neutras con grados de ionización.
Cloruro de plata
El cloruro de plata, AgCl, se disuelve en el agua para producir los iones Ag+ y Cl–. Sin embargo, es una sal bastante insoluble. La cantidad de iones que se liberan es mucho menor que la que se tendría si fuera totalmente soluble, tal como sucede con el nitrato de plata, AgNO3, un electrolito fuerte.
Carbonato de calcio
El carbonato de calcio, CaCO3, es una sal insoluble que al disolverse parcialmente produce iones Ca2+ y CO32-. Esta sal, a diferencia del AgCl, es básica, pues el CO32- se hidroliza para generar iones OH–.
Sulfato de zinc
El sulfato de zinc, ZnSO4, se disuelve parcialmente en el agua para producir iones Zn2+ y SO42-.
Fluoruro de calcio
El fluoruro de calcio, CaF2, encontrada naturalmente como mineral fluorita, se disuelve apenas en el agua para producir iones Ca2+ y F–.
Óxido de magnesio
El óxido de magnesio, MgO, es un compuesto iónico bastante insoluble en el agua. La pequeña porción que se disuelve reacciona para transformarse en el hidróxido correspondiente, Mg(OH)2, el cual es el verdadero responsable de la aparición de los iones Mg2+ y OH–.
Por eso, el MgO, pese a ser iónico, no puede catalogarse como electrolito fuerte, pues en el agua no libera iones de sus propios cristales (Mg2+ y O2-).
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Chung & Chieh. (05 de junio de 2019). Electrolytes. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Todd. (11 de febrero de 2020). Weak Electrolyte Definition and Examples. Recuperado de: thoughtco.com
- Danielle Reid. (2020). Weak Electrolyte: Definition & Examples. Study. Recuperado de: study.com
