Estructura secundaria de las proteínas: características
La estructura secundaria de las proteínas es el nombre con el que se define a la conformación plegada localmente de algunas partes de la cadena polipeptídica. Esta estructura consta de varios patrones que se repiten de forma regular.
Existen muchas formas en las que se pliegan las cadenas de las proteínas. Sin embargo solo unas pocas de estas formas son muy estables. En la naturaleza, las formas más frecuentes que adquieren las proteínas son la hélice α así como la lámina β. Estas estructuras pueden ser descritas por los ángulos de enlace ψ (psi), y φ (phi) de los residuos aminoácidos.
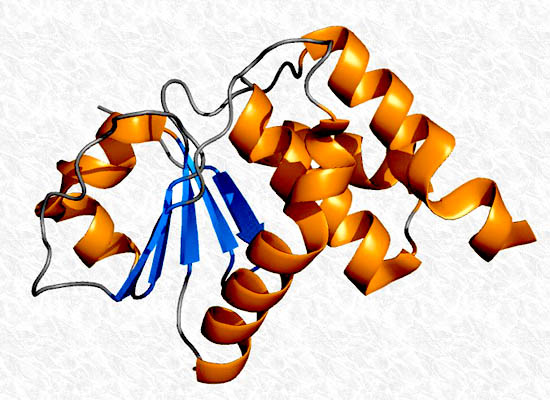
Las interacciones que se establecen entre las cadenas laterales de los residuos aminoácidos pueden ayudar a estabilizar o, por el contrario, desestabilizar la estructura secundaria de las proteínas. La estructura secundaria puede ser observada en la constitución de muchas proteínas fibrosas.
Índice del artículo
En la década de los años 30 del siglo pasado, William Atsbury, trabajando con rayos X, encontró que la proteína del cabello, así como la de las púas del puercoespín, poseían en su estructura segmentos que se repetían regularmente.
Con base en esos resultados, y con el conocimiento de la importancia que representan los enlaces de hidrógeno en la orientación de los grupos polares de los enlaces peptídicos, William Pauling y colaboradores, en consecuencia determinaron hipotéticamente las posibles conformaciones regulares que podrían poseer las proteínas.
Pauling y sus colaboradores, en la década de los años 50, establecieron varios postulados que debían cumplirse en los enlaces de las cadenas polipeptídicas, entre ellos, y en primer lugar, que dos átomos no pueden acercarse mutuamente a una distancia menor a la de sus respectivos radios de Van der Waals.
También indicaron que se necesitan enlaces no covalentes para estabilizar el plegado de las cadenas.
Con base en estos postulados y los conocimientos previos, y empleando modelos moleculares, lograron describir algunas conformaciones regulares de las proteínas, entre ellas, las que posteriormente se demostró que eran las más frecuentes en la naturaleza, como son la hélice α y la lámina β.
Es la estructura secundaria más simple, donde la cadena de polipéptidos se dispone en forma enrollada y compactada alrededor de un eje imaginario. Además, las cadenas laterales de cada aminoácido sobresalen de este esqueleto helicoidal.
Los aminoácidos, en este caso, se disponen de manera que presentan unos ángulos de enlace ψ de -45° a -50°, y φ de -60°. Estos ángulos se refieren al enlace entre el carbono α y el oxígeno del carbonilo y el enlace entre el nitrógeno y el carbono α de cada aminoácido, respectivamente.
Adicionalmente, los científicos han determinado que por cada giro de la hélice α se presentan 3,6 residuos aminoácidos y que este giro siempre es dextrógiro en las proteínas. Además de ser la estructura más sencilla, la hélice α es la forma predominante en las α-queratinas y cerca del 25% de los aminoácidos de las proteínas globulares adoptan esta estructura.
La hélice α está estabilizada gracias a que presenta numerosos puentes de hidrógeno. Así, en cada giro de la hélice se establecen tres o cuatro enlaces de este tipo.
En los puentes de hidrógeno, interaccionan el nitrógeno de un enlace peptídico y el átomo de oxígeno del grupo carbonilo del cuarto aminoácido subsecuente, en dirección del lado amino-terminal de esa cadena.
Los científicos han demostrado que una hélice α puede formarse con cadenas de polipéptidos formadas por L- o por D-aminoácidos, con la condición que todos los aminoácidos tengan la misma configuración estereoisómera. Además, los L-aminoácidos naturales pueden formar hélices α con giro tanto hacia la derecha como hacia la izquierda.
Sin embargo, no todos los polipéptidos pueden formar hélices α estables, debido a que su estructura primaria afecta la estabilidad de esta. Las cadenas R de algunos aminoácidos pueden desestabilizar la estructura, impidiendo la conformación de las hélices α.
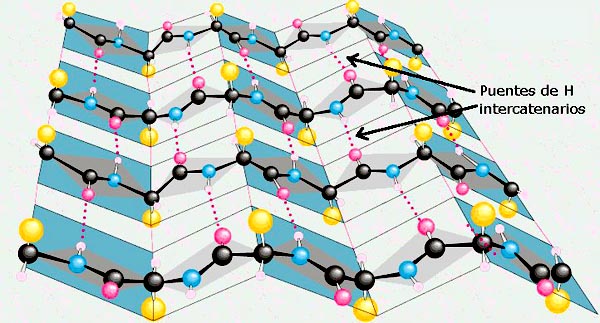
En la lámina β, o lámina plegada β, cada uno de los residuos aminoácidos presenta una rotación de 180° con relación al residuo aminoácido precedente. De esa forma, se obtiene como resultado que el esqueleto de la cadena de polipétidos queda extendida y en forma zigzagueante o de acordeón.
Las cadenas polipeptídicas plegadas en forma de acordeón pueden colocarse adyacentes unas a otras y producir puentes de hidrógeno lineales entre ambas cadenas.
Dos cadenas polipeptídicas adyacentes pueden estar dispuestas en forma paralela, es decir ambas pueden estar orientadas en dirección amino – carboxilo, formándose la lámina β paralela; o pueden estar ubicadas en direcciones opuestas, formándose entonces la lámina β antiparalela.
Las cadenas laterales de los residuos aminoácidos adyacentes sobresalen del esqueleto de la cadena en direcciones opuestas, dando lugar a un patrón alternante. Algunas estructuras proteicas limitan los tipos de aminoácidos de las estructuras β.
Por ejemplo, en proteínas densamente empaquetadas, son más frecuentes los aminoácidos de cadenas R corta, tales como glicina y alanina en sus superficies de contacto.
Esta estructura se caracteriza por presentar 3 residuos aminoácidos por vuelta, en lugar de los 3,6 que presenta la hélice α y un bucle de enlaces de hidrógeno compuesto por 10 elementos. Esta estructura ha sido observada en algunas proteínas, pero no es muy frecuente en la naturaleza.
Esta estructura, por su parte, presenta 4,4 residuos aminoácidos por giro de la espiral y un bucle de enlaces de hidrógenos de 16 elementos. Aunque esta configuración es estéricamente posible, nunca ha sido observada en la naturaleza.
La posible causa de ello puede ser su centro hueco, demasiado grande para permitir la actuación de las fuerzas de Van der Waals que ayudarían a estabilizar a la estructura, y que sin embargo es demasiado pequeño para permitir el paso de moléculas de agua.
Las estructuras supersecundarias son combinaciones de estructuras secundarias de hélices α y láminas plegadas β. Estas estructuras pueden presentarse en muchas proteínas globulares. Existen distintas combinaciones posibles, cada una de las cuales posee características particulares.
Algunos ejemplos de estructuras supersecundarias son: la unidad βαβ, en la cual dos láminas β paralelas están unidas por un segmento de hélice α; la unidad αα, caracterizada por dos hélices α sucesivas pero separadas por un segmento no helicoidal, asociadas por compatibilidad de sus cadenas laterales.
Varias láminas β pueden replegarse sobre si misma dando una configuración de barril β, mientras que una lámina β antiparalela replegada sobre si constituye una estructura supersecundaria denominada llave griega.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3th edition. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper’s Biochemestry. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemestry. 5th edition. W. H. Freeman and Company.
- J.Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. 2nd edition. Thieme.
- A. Lehninger (1978). Bioquímica. Ediciones Omega, S.A.
- T. McKee & J.R. McKee (2003). Biochemistry: The molecular basis of life. 3rd edition. The McGraw-HiII Companies, Inc.
