Número másico: en qué consiste y cómo sacarlo (con ejemplos)
El número másico o número de masa de un átomo es la suma de la cantidad de protones y la cantidad de neutrones del núcleo. A estas partículas se las designa indistintamente con el nombre de nucleones, por lo tanto el número másico representa la cantidad de ellos.
Sea N el número de neutrones presentes y Z el número de protones, si denominamos A como el número másico, entonces:
A = N + Z

Índice del artículo
- 1 Ejemplos de números másicos
- 2 ¿Cómo sacar el número másico?
- 3 Los isótopos
- 4 Ejemplos resueltos
- 5 Referencias
De inmediato algunos ejemplos de números másicos para elementos muy conocidos:
El átomo de hidrógeno más estable y abundante, es también el más sencillo: 1 protón y un electrón. Puesto que el núcleo de hidrógeno no tiene neutrones, se cumple que A = Z = 1.
Un núcleo de oxígeno tiene 8 neutrones y 8 protones, por lo tanto A = 16.
La vida en la Tierra está basada en la química del carbono, un átomo ligero con 6 protones en su núcleo más 6 neutrones, así A = 6 + 6 = 12.
Este elemento bastante más pesado que los anteriores, es muy conocido por sus propiedades radiactivas. El núcleo de uranio posee 92 protones y 146 neutrones. Luego, su número másico es A = 92 + 146 = 238.
Tal como se ha dicho antes, el número másico A de un elemento siempre corresponde a la suma del número de protones y del número de neutrones que contiene su núcleo. También es un número entero, pero… ¿existe alguna regla en cuanto a la relación entre ambas cantidades?
Veamos: todos los elementos mencionados arriba son livianos, excepto el uranio. El átomo de hidrógeno es, como dijimos, el más sencillo. No tiene neutrones, al menos en su versión más abundante, y en el oxígeno y el carbono, hay igual número de protones y neutrones.
También sucede con otros elementos livianos, tal como el nitrógeno, otro gas muy importante para la vida, que tiene 7 protones y 7 neutrones. No obstante, a medida que el núcleo es más complejo y los átomos se vuelven más pesados, el número de neutrones se va incrementando con otro ritmo.
A diferencia de los elementos livianos, el uranio, con 92 protones, posee aproximadamente 1 ½ veces esa cantidad en neutrones: 1 ½ x 92 = 1.5 x 92 = 138.
Como se puede ver, es bastante cercano a 146, la cantidad de neutrones que posee.
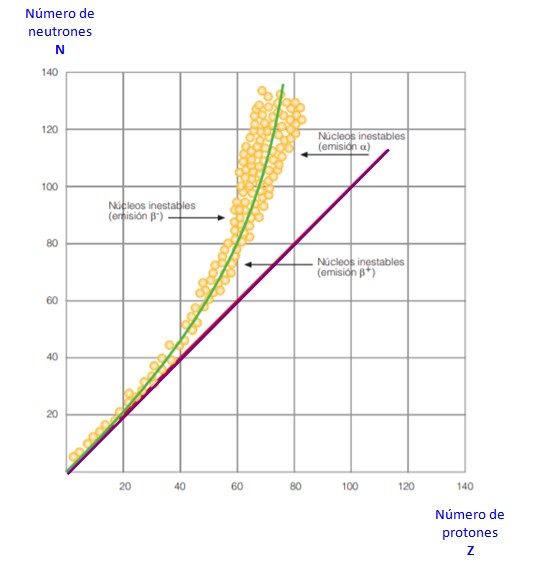
Todo esto se hace evidente en la curva de la figura 2. Se trata de una gráfica de N versus Z, conocida como curva de estabilidad nuclear. Allí se aprecia cómo los átomos ligeros tienen igual número de protones que de neutrones, y cómo a partir de Z = 20 el número de neutrones va en aumento.
De esta forma el átomo grande se vuelve más estable, ya que el exceso de neutrones disminuye la repulsión electrostática entre los protones.
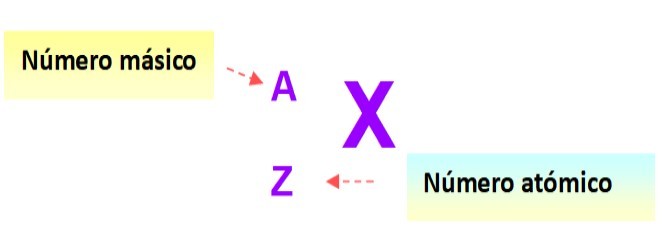
Una notación muy útil que describe rápidamente el tipo de átomo es la siguiente: se escribe el símbolo del elemento y los respectivos números atómicos y de masa como se muestra a continuación en este esquema:
En esta notación, los átomos de los ejemplos anteriores serían:
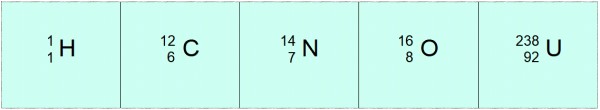
En ocasiones se utiliza otra notación más cómoda, en la que solamente se emplea el símbolo del elemento y el número másico para denotar al átomo, omitiendo el número atómico. De esta forma, el 12 6C se escribe simplemente como carbono-12, el 16 8O sería el oxígeno–16 y así para cualquier elemento.
El número de protones en un núcleo determina la naturaleza del elemento. Por ejemplo, todo átomo cuyo núcleo contiene 29 protones es un átomo de cobre, pase lo que pase.
Supongamos que un átomo de cobre pierde un electrón por la razón que sea, aun así sigue siendo de cobre. Sin embargo ahora es un átomo ionizado.
Es más difícil que un núcleo atómico gane o pierda un protón, pero en la naturaleza puede ocurrir. Por ejemplo en el interior las estrellas se forman continuamente elementos más pesados a partir de elementos livianos, ya que el núcleo estelar se comporta como un reactor de fusión.
Y aquí mismo en la Tierra existe el fenómeno de la desintegración radiactiva, en el cual algunos átomos inestables expulsan nucleones y emiten energía, transformándose en otros elementos.
Finalmente existe la posibilidad de que un átomo de determinado elemento tenga un número másico diferente, en este caso se trata de un isótopo.
Un buen ejemplo es el conocido carbono-14 o radiocarbono, que se usa para datar objetos arqueológicos y como trazador bioquímico. Se trata del mismo carbono, con idénticas propiedades químicas, pero con dos neutrones extra.
El carbono-14 es menos abundante que el carbono-12, el isótopo estable, y además es radioactivo. Esto significa que con el tiempo decae emitiendo energía y partículas hasta transformarse en un elemento estable, que en su caso es el nitrógeno.
El carbono existe en la naturaleza como una mezcla de varios isótopos, del cual el más abundante es el ya mencionado 126C o carbono-12. Y además del carbono-14 está el 136C con un neutrón adicional.
Esto es común en la naturaleza, por ejemplo del estaño se conocen 10 isótopos estables. En cambio, del berilio y el sodio nada más se conoce un solo isótopo.
Cada isótopo, natural o artificial, tiene un ritmo de transformación diferente. De igual forma es posible crear en el laboratorio isótopos artificiales, que por lo general son inestables y decaen radiactivamente en un plazo muy breve de fracciones de segundo, mientras que otros tardan mucho más, tanto como la edad de la Tierra o más.
Tabla de isótopos naturales del carbono
| Isótopos del carbono | Número atómico Z | Número másico A | Abundancia % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Trazas |
¿Cuál es la diferencia entre 137 N y 147 N?
Respuesta
Ambos son átomos de nitrógeno, puesto que su número atómico es 7. Sin embargo uno de los isótopos, el que tiene A = 13, tiene un neutrón menos, mientras que el 147 N es el isótopo más abundante.
¿Cuántos neutrones hay en el núcleo de un átomo de mercurio, denotado como 20180 Hg?
Respuesta
Puesto que A = 201 y Z = 80, y además sabiendo que:
A = Z + N
N = A – Z = 201 – 80 = 121
Y se concluye que el átomo de mercurio tiene 121 neutrones.
- Connor, N. What is Nucleon – Structure of Atomic Nucleus – Definition. Recuperado de: periodic-table.org.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Sears, Zemansky. 2016. University Physics with Modern Physics. 14th. Ed. Volume 2.
- Tippens, P. 2011. Física: Conceptos y Aplicaciones. 7ma Edición. McGraw Hill.
- Wikipedia. Mass Number. Recuperado de: en.wikipedia.org.
