Radio atómico: qué es, cómo se mide, cómo cambia, ejemplos
¿Qué es el radio atómico?
El radio atómico es un parámetro importante para las propiedades periódicas de los elementos de la tabla periódica. Se relaciona directamente con el tamaño de los átomos, ya que a mayor radio, más grandes o voluminosos son. Igualmente, se relaciona con las características electrónicas de los mismos.
Mientras un átomo tenga más electrones, mayor será su tamaño y radio atómicos. Ambos son definidos por los electrones de la capa de valencia, debido a que a distancias más allá de sus órbitas, la probabilidad de encontrar un electrón se aproxima a cero. Lo contrario ocurre en las cercanías del núcleo: la probabilidad de encontrar un electrón se incrementa.
La imagen superior representa un empaquetamiento de bolas de algodón. Obsérvese que cada una se rodea de seis vecinos, sin contar otra posible hilera superior o inferior. El modo en que se compactan las bolas de algodón definirá sus tamaños y, por tanto, sus radios; tal como ocurre con los átomos.
Los elementos según su naturaleza química interactúan con sus propios átomos de un modo u otro. Por consiguiente, la magnitud del radio atómico varía de acuerdo al tipo de enlace presente y con el empaquetamiento sólido de sus átomos.
¿Cómo se mide el radio atómico?

En la imagen anterior puede resultar sencillo medir el diámetro de las bolas de algodón, y acto seguido dividirlo entre dos. No obstante, la esfera de un átomo no está plenamente definida. ¿Por qué? Porque los electrones circulan y se difuminan en regiones concretas del espacio: los orbitales.
Por lo tanto, se puede considerar el átomo como una esfera con bordes impalpables, los cuales es imposible decir a ciencia cierta en dónde terminan. Por ejemplo, en la imagen superior la región del centro, cercana al núcleo, luce un color más intenso, mientras que sus bordes se muestran difuminados.
La imagen representa una molécula diatómica E2 (como el Cl2, H2, O2, etc.). Asumiendo que los átomos son cuerpos esféricos, si se determinara la distancia d que separa ambos núcleos en el enlace covalente, bastaría entonces dividirlo en dos mitades (d/2) para obtener el radio atómico; más precisamente, el radio covalente de E para E2.
¿Y si E no formara enlaces covalentes consigo mismo, sino que se tratara de un elemento metálico? Entonces d vendría indicada por el número de vecinos que rodean a E en su estructura metálica; es decir, por el número de coordinación (N.C) del átomo dentro del empaquetamiento (recordar las bolas de algodón de la imagen).
Determinación de la distancia internuclear
Para determinar d, la cual es la distancia internuclear para dos átomos en una molécula o empaquetamiento, se requiere de técnicas físicas de análisis.
Una de las más empleadas es la difracción de rayos X. En ella se irradia un haz de luz a través de un cristal, y se estudia el patrón de difracción resultante de las interacciones entre los electrones y la radiación electromagnética.
Dependiendo del empaquetamiento, se puede obtener diferentes patrones de difracción y, por lo tanto, otros valores de d.
Si los átomos se encuentran “apretados” en la red cristalina, presentarán valores diferentes de d comparados a los que tendrían si estuvieran “cómodos”.
Asimismo, dichas distancias internucleares podrían oscilar de valores, por lo que el radio atómico consiste en realidad en un valor promedio de tales mediciones.
¿Cómo se relaciona el radio atómico y el número de coordinación? V. Goldschmidt estableció una relación entre ambos, en la cual para un N.C de 12, el valor relativo es de 1; de 0.97 para un empaquetamiento donde el átomo tiene N.C igual a 8; de 0.96, para un N.C igual a 6; y de 0.88 para un N.C de 4.
Unidades
A partir de los valores para N.C igual a 12, se han construido muchas de las tablas donde se comparan los radios atómicos de todos los elementos de la tabla periódica.
Como no todos los elementos forman estructuras tan compactas (N.C menores de 12), se utiliza la relación de V. Goldschmidt para calcular sus radios atómicos y expresarlos para un mismo empaquetamiento. De esta manera se estandarizan las mediciones de los radios atómicos.
Pero, ¿en qué unidades se expresan? Dado que d es de magnitud muy pequeña, debe recurrirse a las unidades del angstrom Å (10∙10-10m) o también ampliamente utilizada, el picómetro (10∙10-12m).
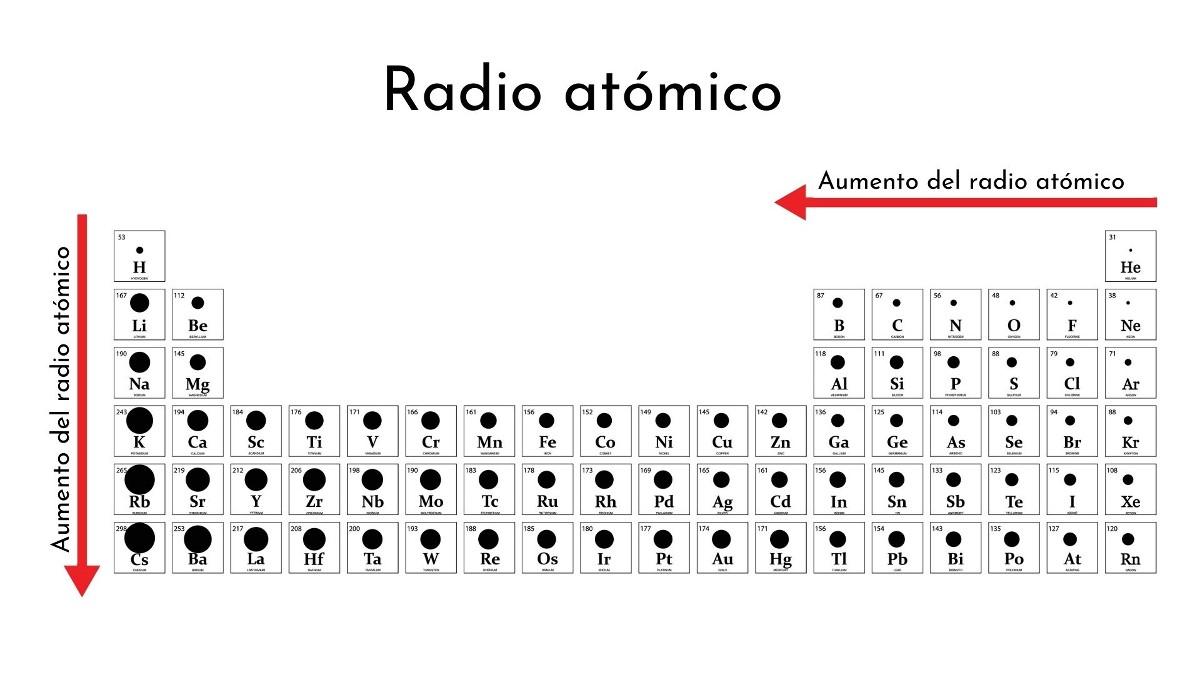
¿Cómo cambia en la tabla periódica?
A lo largo de un período
A los radios atómicos determinados para los elementos metálicos se les dan el nombre de radios metálicos, mientras que para aquellos elementos no metálicos, radios covalentes (como el del fósforo, P4, o el azufre, S8). Sin embargo, entre ambos tipos de radios hay una distinción más prominente que la del nombre.
De izquierda a derecha en un mismo período, el núcleo añade protones y electrones, pero estos últimos se encuentran confinados a un mismo nivel de energía (número cuántico principal).
Como consecuencia, el núcleo ejerce una creciente carga nuclear efectiva sobre los electrones de valencia, lo cual contrae el radio atómico.
De esta manera, los elementos no metálicos en un mismo período tienden a tener radios atómicos (covalentes) más pequeños que los metales (radios metálicos).
Descendiendo por un grupo
Al descender por un grupo se van habilitando nuevos niveles de energía, los cuales permiten a los electrones disponer de más espacio. Así, la nube electrónica abarca mayores distancias, su difuminada periferia termina alejándose más del núcleo, y, por tanto, se expande el radio atómico.
Contracción lantánida
Los electrones de la capa interna ayudan a apantallar la carga nuclear efectiva sobre los electrones de valencia. Cuando los orbitales que conforman las capas internas tienen muchos “huecos” (nodos), como ocurre con los orbitales f, el núcleo contrae fuertemente el radio atómico debido al pobre efecto de apantallamiento de los mismos.
Este hecho se evidencia en la contracción lantánida en el período 6 de la tabla periódica. Del La al Hf hay una considerable contracción del radio atómico producto de los orbitales f, los cuales se “llenan” a medida que se recorre el bloque f: el de los lantanoides y actinoides.
Un efecto similar también puede observarse con los elementos del bloque p a partir del período 4. Esta vez producto del débil efecto apantallante de los orbitales d que se llenan al recorrer los períodos de los metales de transición.
Ejemplos de radios atómicos
Para el período 2 de la tabla periódica los radios atómicos de sus elementos son:
-Li: 257 pm
-Be: 112 pm
-B: 88 pm
-C: 77 pm
-N: 74 pm
-O: 66 pm
-F: 64 pm
Nótese que el metal litio posee el radio atómico más grande (257 pm), mientras que el flúor, ubicado en el extremo derecho del período, es el más pequeño de todos ellos (64 pm). El radio atómico desciende de izquierda a derecha en un mismo período, y los valores enlistados lo demuestran.
El litio, al formar enlaces metálicos, su radio es metálico; y el flúor, como forma enlaces covalentes (F-F), su radio es covalente.
¿Y si se desean expresar los radios atómicos en unidades de angstrom? Bastará con dividirlos entre 100: (257/100)= 2.57Å. Y así sucesivamente con el resto de los valores.
Referencias
- Chemistry 301. Atomic Radii. Recuperado de: ch301.cm.utexas.edu
- CK-12 Foundation (2016). Atomic Radius. Recuperado de: chem.libretexts.org
- Trends in Atomic Radii. Tomado de: intro.chem.okstate.edu
- Clackamas Community College (2002). Atomic Size. Recuperado de: dl.clackamas.edu
- Clark J. (2012). Atomic and Ionic Radius. Recuperado de: chemguide.co.uk
- Shiver & Atkins. (2008). Química Inorgánica (Cuarta edición, pág. 23, 24, 80, 169). Mc Graw Hill.
