Ley de las proporciones múltiples: explicación y ejemplos
¿Qué es la ley de las proporciones múltiples?
La ley de las proporciones múltiples establece que si dos elementos forman más de un compuesto cuando reaccionan entre sí, entonces la proporción de las masas con que uno de ellos se combina con una masa fija del otro, es igual a una relación de números enteros pequeños.
El enunciado de la ley puede parecer complejo si no se tiene un ejemplo a la mano. Considérese pues unas galletas Oreos, compuestas por dos tapas de chocolate y una franja de crema azucarada: T2C (T= tapa y C= crema). Si quisiéramos inventar una galleta Oreo más robusta, añadiríamos otra franja de crema, para así tener doble crema (T2C2 o TC).

También pudiéramos añadir otra más, para que la galleta tenga tres veces más crema que una galleta convencional (T2C3). ¿Y si le colocamos otra tapa de chocolate en el medio de las franjas blancas (T3C2)? Las opciones son ilimitadas; pero siempre sumamos una unidad de tapa o crema. No pensamos en una mitad de tapa (1/2 T), o un quinto de crema (1/5 C), pues sería inadecuado.
Del mismo modo sucede con los elementos químicos: sus átomos no se fraccionan para formar compuestos. Por lo tanto, las masas de T o C entre sus compuestos guardan “siempre” una relación sencilla.
Explicación
Proporciones
La ley de las proporciones múltiples, junto con la ley de las proporciones definidas, precedieron a la estequiometría y las primeras fórmulas químicas. Olvidémonos de las galletas, pero conservemos sus símbolos: T y C. Mediante experimentos, se descubre que los elementos T y C forman varios compuestos: T2C, TC y T2C3.
Antes de las fórmulas químicas era imposible saber de una vez cuáles eran realmente las proporciones de las masas de T y C en tales compuestos. Había que primero determinarlas. En un compuesto, se descubrió que la masa de T duplicaba a la de C; por decir, 2 gramos de T se combinan con 1 gramo de C.
Luego, en el otro compuesto se tuvo que las masas de T y C se igualaban: 2 gramos de T ahora se combinan con 2 gramos de C. Aquí surge la pregunta: ¿y si T y C todavía pueden formar otro compuesto? Si así fuera, seguramente se formaría partiendo con 2 gramos de T, pero esta vez se combinarían con 3 gramos de C (1 gramo + 1 gramo + 1 gramo).
Relaciones de masa simples
Las proporciones de las masas con que T y C reaccionan permiten establecer sus fórmulas químicas: T2C (2 gramos T: 1 gramo C), TC (2 gramos T: 2 gramos C) y T2C3 (2 gramos T: 3 gramos C). Si queremos comparar las relaciones de las masas de T o C en dichos compuestos, es necesario que una de sus masas permanezca constante; en este caso la de T: 2 gramos.
Por lo tanto, determinaremos las proporciones de masa de C en dichos tres compuestos:
- T2C: 1 gramo C/2 gramos T
- TC: 2 gramos C/2 gramos T
- T2C3: 3 gramos C/2 gramos T
Tendremos así una relación para la masa de C igual a 1:2:3. Es decir, hay 2 veces más C en TC que en T2C, y 3 veces más C en T2C3 que en T2C. Como puede verse, 1:2:3 son números enteros pequeños (no superan siquiera la decena).
Ejemplos de la ley de las proporciones múltiples
Para los ejemplos siguientes se aplicarán los mismos pasos anteriores, pero tendremos en cuenta las masas molares de los respectivos elementos, asumiendo un mol del compuesto.
CO-CO2
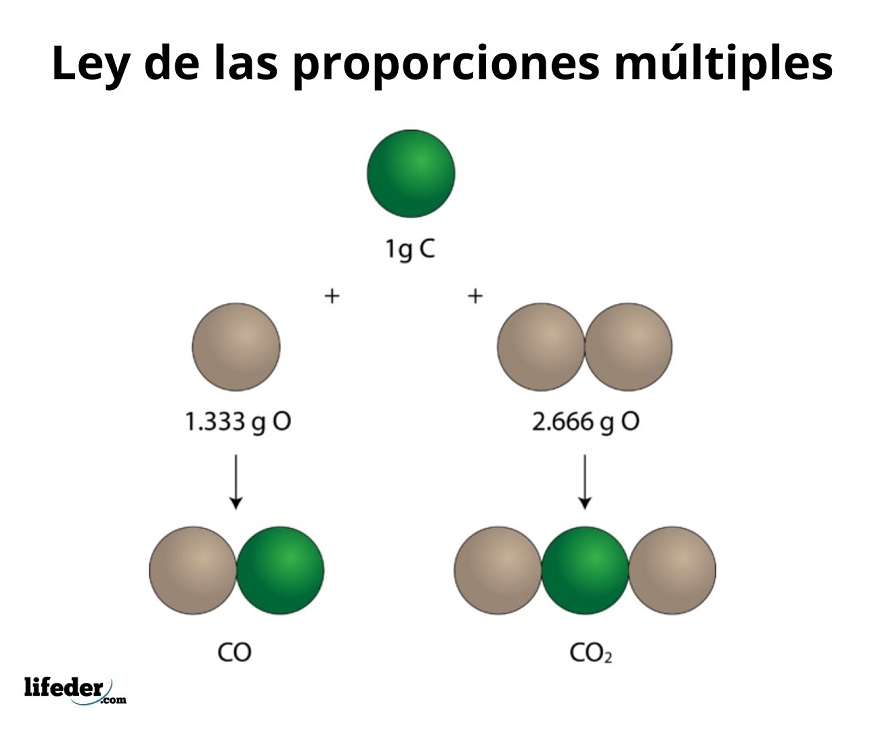
Este ejemplo explica de forma sencilla cómo funciona la ley de proporciones múltiples; en el CO (monóxido de carbono), hay 1.333 gramos de oxígeno por cada gramo de carbono. En el dióxido de carbono (CO₂), hay 2.666 gramos de oxígeno por cada gramo de carbono. Por tanto, la proporción de oxígeno en ambos compuestos es 1:2, un número entero pequeño.
H2O-H2O2
La ley de proporciones múltiples aplica para el par de compuestos H2O-H2O2.
En un mol de H2O, 2 gramos de hidrógeno se combinan con 16 gramos de oxígeno. Mientras, en un mol de H2O2, 2 gramos de hidrógeno se combinan con 32 gramos de oxígeno. Para comprobar si se cumple esta ley, debemos fijar una misma masa para uno de los elementos en ambos compuestos. Esta vez es el hidrógeno: 2 gramos.
Las proporciones de masa para el O en el H2O y H2O2 son:
- H2O: 16 gramos O/2 gramos H
- H2O2: 32 gramos O/2 gramos H
La relación de la masa de O será 16:32. Sin embargo, podemos simplificarla dividiendo entre 16, quedándonos 1:2. Otra vez, la relación final está compuesta por números enteros pequeños.
SO2-SO3
En un mol de SO2, 32 gramos de azufre se combinan con 32 gramos de oxígeno. Mientras, en un mol de SO3, 32 gramos de azufre se combinan con 48 gramos de oxígeno. La masa del azufre es la misma para ambos compuestos, así que podemos comparar directamente las proporciones de oxígeno:
- SO2: 32 gramos O
- SO3: 48 gramos O
Siendo la relación de la masa de oxígeno entre ambos compuestos igual a 32:48 o 1:1.5. Pero, ¿no se suponía que debía haber números enteros? La relación 1:1.5 (1/1.5) también puede escribirse como 2:3 (0.6), y otra vez tendremos números enteros pequeños: 2 y 3.
Nótese que también podríamos haber escrito la relación como 48:32 o 1.5:1, siendo el resultado 3:2. La ley no cambia, solo la interpretación de la relación: Hay 1.5 o 3/2 veces más oxígeno en el SO3 que en el SO2; lo cual es lo mismo decir que hay 2/3 o 0.6 veces menos oxígeno en el SO2 que en el SO3.
NO-NO2-N2O-N2O3-N2O5
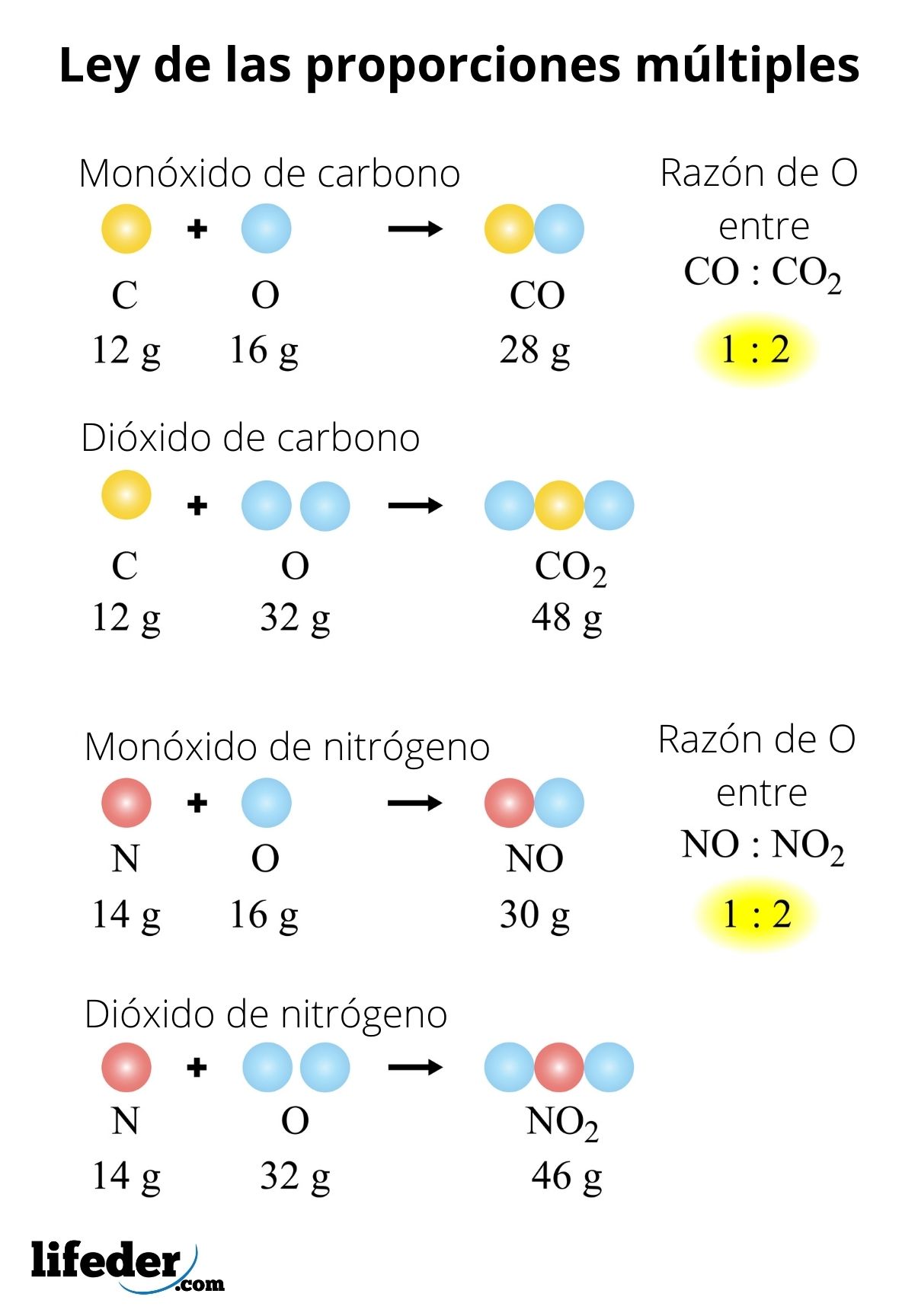
La ley también puede aplicarse para una serie de compuestos. Considérese pues los óxidos de nitrógeno: NO-NO2-N2O-N2O3-N2O5. Para poder evaluar esta ley en ellos debemos fijar una masa de nitrógeno: 28 gramos. ¿Por qué? Porque NO y NO2 tienen un átomo de nitrógeno menos que los demás óxidos:
- 2(NO): 28 gramos N/32 gramos O
- 2(NO2): 28 gramos N/64 gramos O
- N2O: 28 gramos N/ 16 gramos O
- N2O3: 28 gramos N/ 48 gramos O
- N2O5: 28 gramos N/ 80 gramos O
Olvidémonos pues del nitrógeno y centrémonos en los gramos de oxígeno:
- 2(NO): 32 gramos O
- 2(NO2): 64 gramos O
- N2O: 16 gramos O
- N2O3: 48 gramos O
- N2O5: 80 gramos O
Siendo la relación de las masas de O igual a 32:64:16:48:80. Para simplificarla, dividimos todos sus números entre el más pequeño, el 16, quedando como 2:4:1:3:5.
Es decir, hay: 2 veces más oxígeno en el NO que en el N2O, 4 veces más oxígeno en el NO2 que en el N2O, 3 veces más oxígeno en el N2O3 que en el N2O, y 5 veces más oxígeno en el N2O5 que en el N2O. Nuevamente, tenemos números enteros pequeños, que van desde el 1 hasta el 5.
Limitaciones
La ley de las proporciones múltiples no se cumple siempre. Por ejemplo, las masas molares o pesos atómicos de los elementos no son cifras enteras, sino que posee muchos decimales. Esto modifica completamente las relaciones calculadas, las cuales dejan de ser simples.
Asimismo, la ley no se cumple para compuestos pesados, como algunos hidrocarburos. Por ejemplo, el undecano, C11H24, tiene 1.0083 o 121/120 veces más hidrógeno que el decano, C10H22, cuya relación está compuesta por 121 y 120, los cuales sobrepasan de la decena; no son números enteros pequeños.
Y finalmente, la ley falla con los compuestos no estequiométricos, como sucede con muchos óxidos y sulfuros.
Conclusión
La ley de proporciones múltiples afirma que cuando dos elementos forman más de un compuesto, las diferentes masas de un elemento que combinan con la misma masa del otro elemento se encuentran en una proporción de un número entero pequeño.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Law of multiple proportions. Recuperado de: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (2020). Law of multiple proportions. Recuperado de: britannica.com
- ChemistryGod. (04 de junio de 2019). Law of multiple proportions by Dalton. Recuperado de: chemistrygod.com
- Garcia Nissa. (2020). Law of Multiple Proportions: Definition & Examples. Study. Recuperado de: study.com
