Principio de Aufbau: qué es, explicación, ejemplos, excepciones
¿Qué es el principio de Aufbau?
El principio de Aufbau, también conocido como regla de la lluvia o principio de construcción, es una regla práctica que permite predecir la configuración electrónica de la gran mayoría de los elementos de la tabla periódica, así como la de sus iones.
Este principio establece que, a medida que se van añadiendo protones al núcleo, de uno en uno para ir construyendo sucesivamente cada elemento químico, los electrones también se van añadiendo sucesivamente a los orbitales atómicos de menor energía que estén disponibles.
En otras palabras, Aufbau estableció que hay un orden específico según el cual se pueden ir llenando los orbitales atómicos. Este orden se explica a continuación.
El orden de llenado de los orbitales según el principio de Aufbau
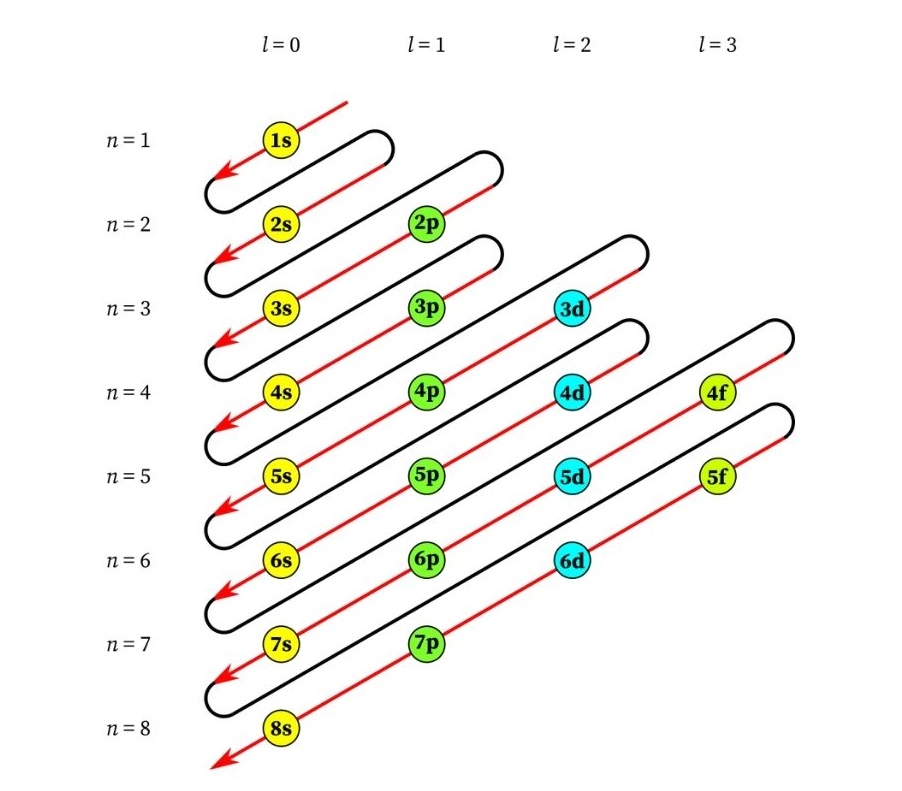
El orden en el que se van llenando los orbitales atómicos depende de su nivel de energía. La regla de oro es que estos niveles de energía se van llenando de menor a mayor, como si se tratara de un edificio en el que se deben ir llenando los apartamentos en los pisos más bajos para poder acceder a los pisos más altos.
En este sentido, para poder predecir el orden de llenado de los orbitales, primero debemos conocer cómo están ordenados según su nivel de energía. En la analogía del edificio, esto significa saber qué apartamentos (orbitales) hay en cada piso.
El siguiente gráfico muestra esquemáticamente los niveles de energía de los primeros orbitales atómicos ordenados de menor a mayor energía.
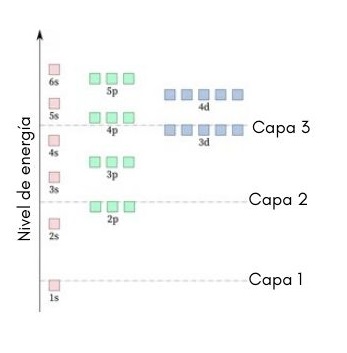
En esta imagen, cada cuadro representa un orbital particular en el que caben solo 2 electrones. Cada grupo de cuadros del mismo color representa un subnivel de energía.
Estos subniveles están identificados por un número y una letra (1s, 3p, 3d, etc.). El número indica el nivel principal de energía, mientras que la letra indica el tipo de orbital que forma el grupo.
De acuerdo a este esquema, el primer subnivel que se debe llenar es el 1s (el de menor energía de todos), luego viene, el 2s, el 2p, el 3s, el 3p, el 4s, el 3d y así sucesivamente.
La regla de la lluvia
A pesar de lo fácil que resulta establecer el orden de llenado si se tiene una gráfica como la anterior, resulta difícil recordar el orden particular en el que van los distintos subniveles. Para esto se utiliza lo que algunos llaman “la regla de la lluvia”.
Esta regla consiste en dos simples pasos:
Paso 1
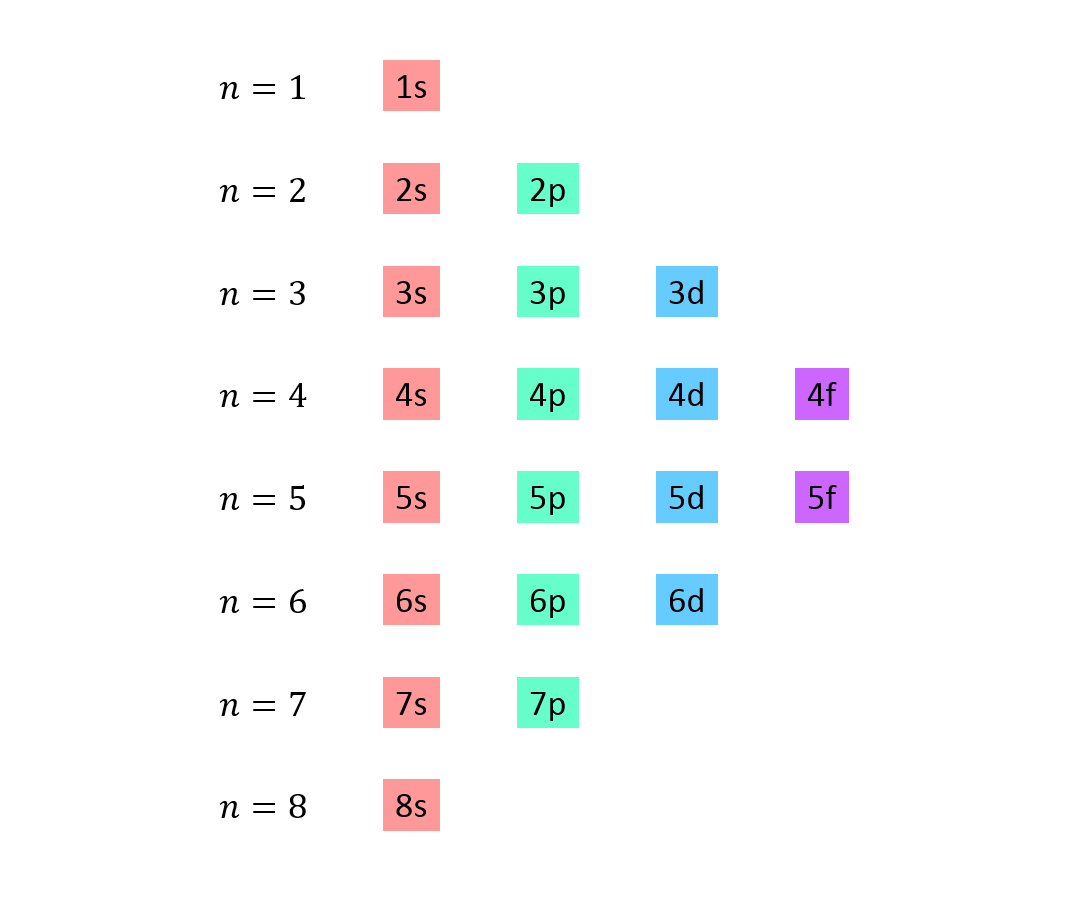
Se hace una lista en la que cada línea corresponde a un nivel de energía, y contiene uno después de otro, todos los subniveles disponibles en dicho nivel de energía.
Por ejemplo, la primera línea corresponde al nivel 1 (n=1) y solo contiene al subnivel 1s; la segunda línea corresponde al nivel n=2 y contiene a los subniveles 2s y 2p; la tercera contiene los subniveles 3s, 3p y al 3d, y así sucesivamente.
La lista completa se ve así:
Paso 2
Se dibujan diagonales descendentes de derecha a izquierda, una debajo de la otra, como se muestra a continuación.
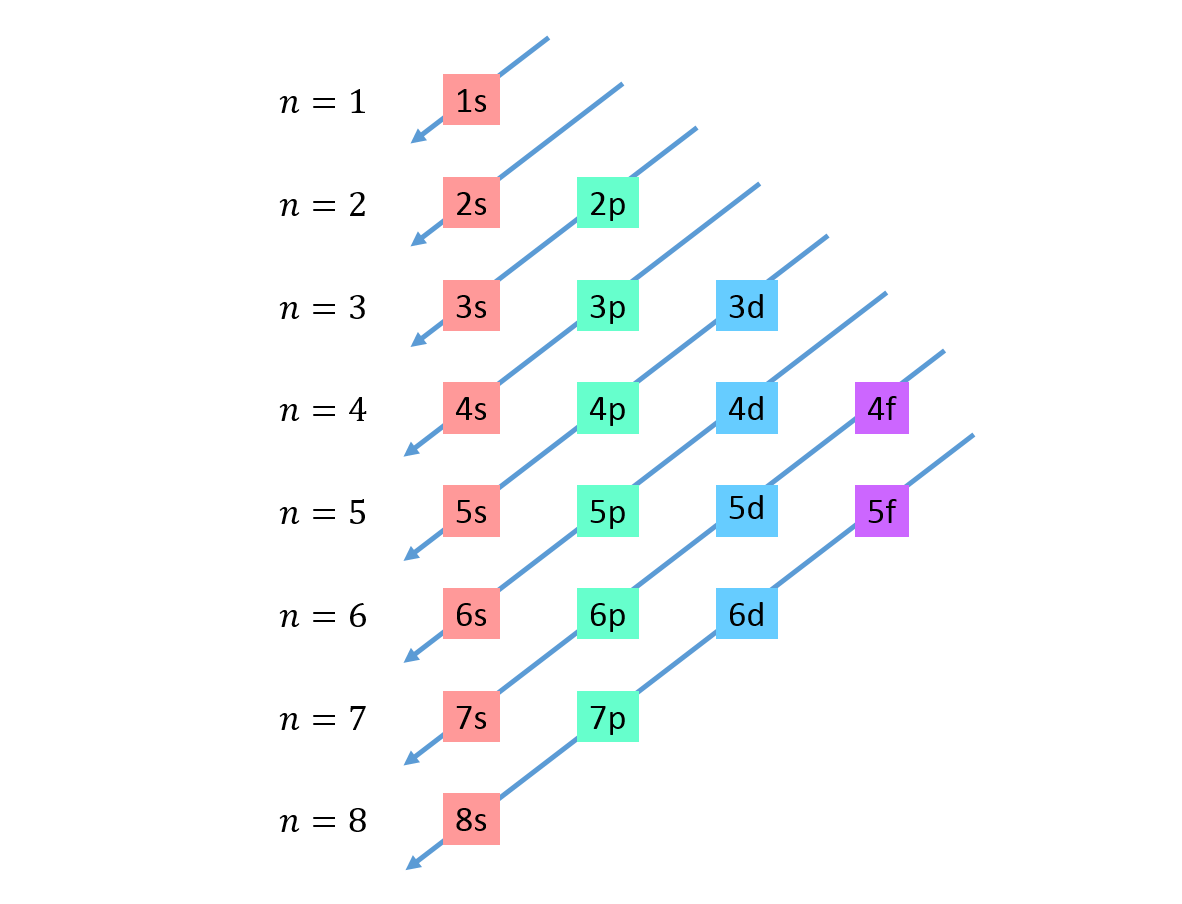
Estas líneas se asemejan al recorrido de las gotas de agua durante una lluvia con viento, por lo que a esta gráfica se le suele llamar “el método de la lluvia”. El orden de llenado viene determinado por el orden en el que estas diagonales van tocando a los subniveles en la lista.
En base a la figura anterior, el orden de energía de los orbitales y, por lo tanto, el orden en el que se deben llenar es:
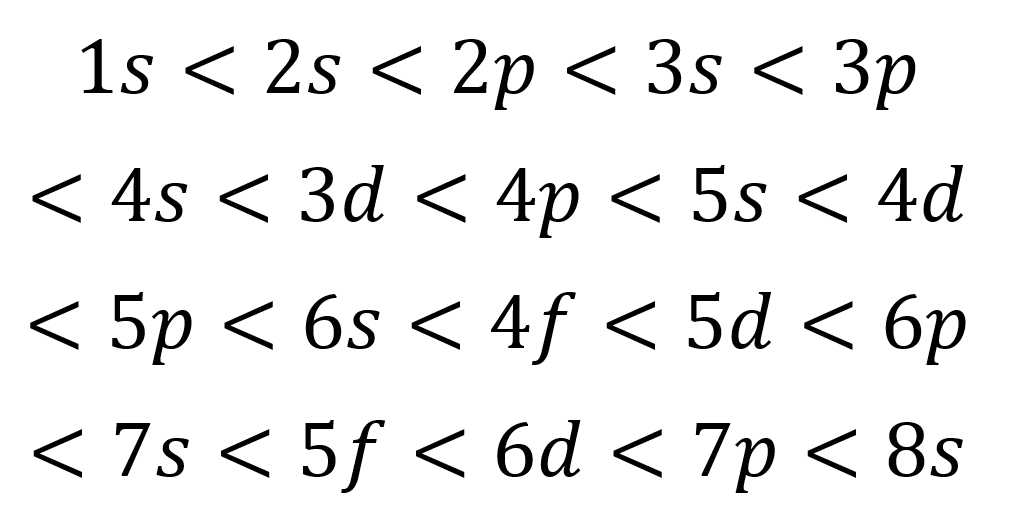
Este orden de llenado es el único que realmente importa al momento de escribir la configuración electrónica de un átomo. Al llenar estos subniveles, se debe recordar que en los subniveles s solo caben 2 electrones, en los p caben 6, en los d caben 10 y en los f caben 14.
Excepciones al principio de Aufbau
El principio de Aufbau establece claramente que no se puede empezar a llenar un subnivel hasta haber llenado por completo todos los subniveles anteriores. Sin embargo, existen algunas excepciones a esta regla.
En algunos casos, el átomo prefiere tener un subnivel de energía lleno justamente a la mitad que tener uno incompleto que no esté lleno a la mitad. En esos casos, la configuración electrónica real del átomo no concuerda con el orden predicho por el método de la lluvia.
Por ejemplo, según el principio de Aufbau, el átomo de cromo debería tener una configuración electrónica que termine en 4s2 3d4. Sin embargo, su configuración real es 4s1 3d5 ya que así los subniveles 4s y 3d están llenos a la mitad mientras que en la otra configuración no.
Lo mismo sucede con el cobre cuya configuración termina en 4s1 3d10, en lugar de 4s2 3d9, ya que así llena el subnivel d y el s queda lleno a la mitad.
Ejemplos de la aplicación del principio de Aufbau
A continuación, se presentan 5 ejemplos de elementos que cumplen con el principio de Aufbau:
Ejemplo 1: Configuración electrónica del sodio
El sodio es el elemento 11, por lo que tiene 11 protones y 11 electrones. Su configuración electrónica es 1s2 2s2 2p6 3s1.
Ejemplo 2: Configuración electrónica del argón
El argón (Ar) es el elemento 18, por lo que tiene 18 protones y 18 electrones. Su configuración electrónica es, por lo tanto, 1s2 2s2 2p6 3s23p6. Se puede observar que llenó por completo sus subniveles s y p.
Ejemplo 3: Configuración electrónica del galio
El galio (Ga) es el elemento 31, por lo que tiene 31 protones y 31 electrones. Su configuración electrónica es 1s2 2s2 2p6 3s23p64s23d104p1.
Esto se puede escribir de forma resumida como [Ar] 4s23d104p1, donde [Ar] representa la configuración electrónica del argón presentada en el ejemplo anterior.
Ejemplo 4: Configuración electrónica del carbono
El carbono (C) es el elemento 6, por lo que tiene 6 protones y 6 electrones. Su configuración electrónica es 1s2 2s2 2p2.
Ejemplo 5: Configuración electrónica del cloro
El cloro (Cl) es el elemento 17. Sus 17 electrones están distribuidos de acuerdo a la siguiente configuración electrónica: 1s2 2s2 2p6 3s23p5 o [Ne] 3s23p5.
Ejemplos adicionales de excepciones al principio de Aufbau
A continuación, se presentan 2 ejemplos adicionales de elementos que violan el principio de Aufbau:
Ejemplo 6: Configuración electrónica del Molibdeno
El molibdeno (Mo) es el elemento 42. Los primeros 36 electrones están distribuidos de igual forma que en el criptón, pero sus electrones de valencia no siguen el orden normal. En lugar de tener la configuración electrónica [Kr]5s24d4, su configuración es [Kr]5s14d5, de manera similar a lo que sucede con el cromo.
Ejemplo 7: Configuración electrónica del Plata
La plata (Ag, elemento 47) presenta una violación del principio de Aufbau similar a la del cobre. Su configuración electrónica es [Kr]5s14d10 en lugar de [Kr]5s24d9.
