Enzima: funcionamiento y ejemplos
Una enzima, catalizador biológico o biocatalizador es una molécula, generalmente de origen proteico, que tiene la capacidad de acelerar las reacciones químicas que ocurren en el interior de los seres vivos. Las moléculas proteicas catalizadoras son las enzimas, y las de naturaleza de ARN son ribozimas.
En ausencia de las enzimas, el número enorme de reacciones que tienen lugar en la célula y que permiten la vida, no podrían ocurrir. Estos se encargan de acelerar el proceso en órdenes de magnitud cercanos a 106 – y en algunos casos mucho mayor.
Índice del artículo
- 1 Catálisis
- 2 Enzimas
- 3 Diferencia entre los catalizadores biológicos (enzimas) y los catalizadores químicos
- 4 Referencias
Un catalizador es una molécula capaz de alterar la velocidad de una reacción química sin ser consumido en dicha reacción.
Las reacciones químicas involucran energía: las moléculas iniciales involucradas en la reacción o reactantes empiezan con un grado de energía. Una cantidad adicional de energía es absorbida para alcanzar el “estado de transición”. Posteriormente, la energía es liberada con los productos.
La diferencia de energía entre los reactantes y los productos se expresa como ∆G. Si los niveles de energía de los productos es mayor que los reactantes la reacción es endergónica y no es espontánea. En contraste, si la energía de los productos es menor, la reacción es exergónica y espontánea.
Sin embargo, que una reacción sea espontánea, no quiere decir que ocurrirá a una velocidad apreciable. La velocidad de la reacción depende del ∆G* (el asterisco hace referencia a la energía de activación).
El lector debe mantener estos conceptos en mente para poder entender cómo ocurre el funcionamiento de las enzimas.
Las enzimas son moléculas biológicas de una complejidad increíble, formada principalmente por proteínas. Las proteínas, a su vez, son largas cadenas de aminoácidos.
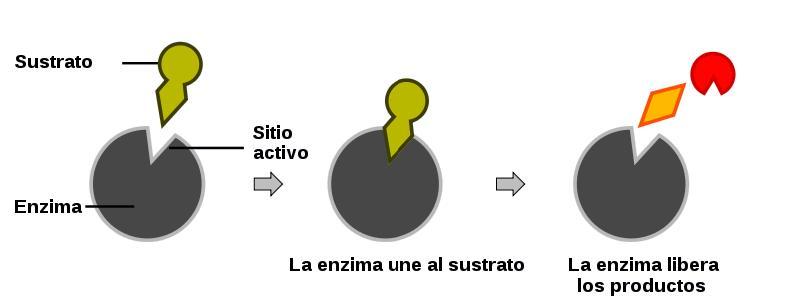
Una de las características más destacadas de las enzimas es su especificidad en la molécula blanco – esta molécula se denomina sustrato.
Las enzimas existen en varias formas. Algunas están compuestas totalmente de proteínas, mientras otras poseen regiones de naturaleza no proteica denominadas cofactores (metales, iones, moléculas orgánicas, etc).
Así, una apoenzima es una enzima sin su cofactor, y la combinación de la apoenzima y su cofactor se denominan holoenzima.
Son moléculas de un tamaño considerablemente grande. Sin embargo, solo un pequeño sitio de la enzima participa directamente en la reacción con el sustrato, y esta región es el sitio activo.
Cuando la reacción empieza la enzima se acopla con su sustrato como una llave se acopla con su cerradura (este modelo es una simplificación del proceso biológico real, pero sirve para ilustrar el proceso).
Todas las reacciones químicas que ocurren en nuestro cuerpo están catalizadas por enzimas. De hecho, si estas moléculas no existieran, tuviéramos que esperar cientos o miles de años para que las reacciones se completasen. Por ello, la regulación de la actividad enzimática debe ser controlada de manera muy específica.
Cuando vemos una molécula cuyo nombre termina en –asa, podemos estar seguros de que es una enzima (aunque existen excepciones a esta regla, como la tripsina). Esta es la convención para designar el nombre de las enzimas.
Existen seis tipos básicos de enzimas: oxidorreductasas, transferasas, hidrolasas, liasas, isomerasas y ligasas; encargadas de: reacciones redox, transferencia de átomos, hidrólisis, adición de dobles enlaces, isomerización y unión de moléculas, respectivamente.
En el apartado de catálisis mencionamos que la velocidad de la reacción depende del valor de ∆G*. Mientras mayor es este valor, la reacción es cada vez más lenta. La enzima se encarga de disminuir dicho parámetro – incrementando así la velocidad de la reacción.
La diferencia entre los productos y los reactantes permanece idéntica (la enzima no lo afecta), igual que la distribución de los mismos. La enzima facilita la formación del estado transición.
En el contexto del estudio de las enzimas, los inhibidores son sustancias que logran disminuir la actividad del catalizador. Se clasifican en dos tipos: inhibidores competitivos y no competitivos. Los del primer tipo compiten con el sustrato y los otros no lo hacen.
Generalmente el proceso de inhibición es reversible, aunque algunos inhibidores pueden permanecer acoplados a la enzima de manera casi permanente.
Existe una amplia cantidad de enzimas en nuestras células – y en las células de todos los seres vivos. Sin embargo, las más conocidas son las que participan en rutas metabólicas como la glucólisis, ciclo de Krebs, cadena transportadora de electrones, entre otras.
La succinato deshidrogenasa es una enzima del tipo oxidorreductasa que cataliza la oxidación del succinato. En este caso, la reacción involucra la pérdida de dos átomos de hidrógeno.
Existen catalizadores de naturaleza química que, como los biológicos, incrementan la velocidad de las reacciones. Sin embargo, hay diferencias notables entre ambos tipos de moléculas.
En primer lugar, las enzimas logran incrementar la velocidad de las reacciones en órdenes de magnitud cercanas a 106 hasta 1012. Los catalizadores químicos también incrementan la velocidad, pero solo unos pocos órdenes de magnitud.
Como las reacciones biológicas son llevadas a cabo en el interior de los seres vivos, sus condiciones óptimas rodean los valores fisiológicos de temperatura y pH. Los químicos, por su parte, necesitan condiciones drásticas de temperatura, presión y acidez.
Las enzimas son muy específicas en las reacciones que catalizan. En la mayoría de los casos, solamente trabajan con un sustrato o con unos pocos. La especificidad también se aplica para el tipo de productos que producen. El rango de sustratos de los catalizadores químicos es mucho más amplio.
Las fuerzas que determinan la especificidad de la interacción entre la enzima y su sustrato son las mismas que dictan la conformación de la proteína misma (interacciones de Van der Waals, electrostáticas, enlaces de hidrógeno e hidrofóbicas).
Por último, las enzimas tienen una mayor capacidad de regulación y la actividad de estas varían de acuerdo a la concentración de distintas sustancias en la célula.
Entre los mecanismos de regulación encontramos el control alostérico, la modificación covalente de las enzimas y la variación en la cantidad de enzima que se sintetiza.
- Berg, J. M., Stryer, L., & Tymoczko, J. L. (2007). Bioquímica. Reverté.
- Campbell, M. K., & Farrell, S. O. (2011). Biochemistry. Sixth edition. Thomson. Brooks/Cole.
- Devlin, T. M. (2011). Textbook of biochemistry. John Wiley & Sons.
- Koolman, J., & Röhm, K. H. (2005). Bioquímica: texto y atlas. Ed. Médica Panamericana.
- Mougios, V. (2006). Exercise biochemistry. Human Kinetics.
- Müller-Esterl, W. (2008). Bioquímica. Fundamentos para medicina y ciencias de la vida. Reverté.
- Poortmans, J.R. (2004). Principles of exercise biochemistry. Karger.
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
