Estructura cuaternaria de las proteínas: características
La estructura cuaternariade las proteínas define las relaciones espaciales entre cada una de sus subunidades de polipéptidos unidas por fuerzas no covalentes. En las proteínas poliméricas, cada una de las cadenas de polipéptidos que la conforman reciben el nombre de subunidades o protómeros.
Las proteínas pueden estar formadas por uno (monoméricas), dos (diméricas), varios (oligoméricas) o muchos protómeros (poliméricas). Estos protómeros pueden poseer una estructura molecular similar o muy diferente entre ellos. En el primer caso se dice que son proteínas homotípicas y en el segundo caso, heterotípicas.

En la notación científica, los bioquímicos emplean letras griegas con subíndices para describir la composición de protómeros de las proteínas. Por ejemplo, una proteína homotípica tetramérica se designa como α4, mientras que una proteína tetramérica formada por dos dímeros distintos se designa como α2β2.
Índice del artículo
- 1 Estructura proteica
- 2 Estabilidad de la estructura cuaternaria
- 3 Interacciones entre protómeros
- 4 Referencias
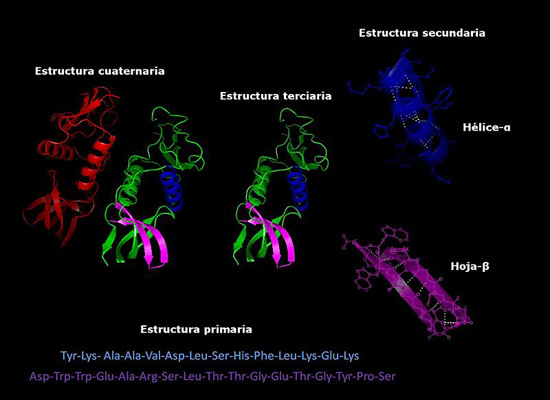
Las proteínas son moléculas complejas que adquieren distintas configuraciones tridimensionales. Estas configuraciones son exclusivas para cada proteína y les permiten desempeñar funciones muy específicas. Los niveles de organización estructural de las proteínas son los siguientes.
Se refiere a la secuencia en que están dispuestos los distintos aminoácidos en la cadena polipeptídica. Esta secuencia viene dada por la secuencia del ADN que codifica dicha proteína.
La mayoría de las proteínas no son largas cadenas de aminoácidos completamente extendidas, sino que poseen regiones que se encuentran plegadas regularmente en forma de hélices o láminas. Este plegado, es el que recibe el nombre de estructura secundaria.
Las zonas plegadas de la estructura secundaria pueden, a su vez, plegarse y ensamblarse en estructuras más compactas. Este último plegado es el que otorga a la proteína su forma tridimensional.
En las proteínas que están formadas por más de una subunidad, las estructuras cuaternarias son las relaciones espaciales que existen entre cada subunidad, las cuales se encuentran unidas por enlaces no covalentes.
La estructura tridimensional de las proteínas está estabilizada por interacciones débiles o no covalentes. Si bien estos enlaces o interacciones son mucho más débiles que los enlaces covalentes normales, estos son numerosos y su efecto acumulativo es poderoso. A continuación veremos algunas de las interacciones más comunes.
Algunos aminoácidos contienen cadenas laterales hidrófobas. Cuando las proteínas poseen estos aminoácidos, el plegamiento de la molécula ordena estas cadenas laterales hacia el interior de la proteína y las protege del agua. La naturaleza de las distintas cadenas laterales hace que estas contribuyan de diferentes maneras en el efecto hidrófobo.
Estas interacciones ocurren cuando moléculas o átomos que no están unidos por enlaces covalentes se aproximan demasiado entre ellos, y debido a ello sus orbitales electrónicos más externos comienzan a solaparse.
En ese momento se establece una fuerza de repulsión entre estos átomos que crece muy rápidamente a medida que sus respectivos centros se aproximan. Estas son las llamadas “fuerzas de van der Waals”.
Es la interacción electrostática que ocurre entre un par de partículas cargadas. En las proteínas ocurren este tipo de interacciones, tanto debido a la carga eléctrica neta de la proteína, como a la carga individual de los iones contenidos en su interior. Este tipo de interacciones es denominado en ocasiones puente salino.
Un enlace de hidrógeno se establece entre un átomo de hidrógeno unido, mediante enlace covalente, a un grupo donador del enlace de hidrógeno y un par de electrones libres pertenecientes a un grupo aceptor del enlace.
Este tipo de enlace es muy importante, pues las propiedades de muchas moléculas, incluyendo la del agua y moléculas biológicas, se deben en gran parte a los enlaces de hidrógeno. Comparte propiedades de los enlaces covalentes (se comparten electrones) y también de las interacciones no covalentes (interacción carga-carga).
En moléculas, incluyendo proteínas, que no presentan carga neta, se puede presentar una disposición no uniforme de sus cargas internas, con un extremo ligeramente más negativo que otro. Esto es lo que se conoce como un dipolo.
Esta condición dipolar de la molécula puede ser permanente, pero también puede ser inducida. Los dipolos pueden ser atraídos por iones o por otros dipolos. Si los dipolos son permanentes, la interacción tiene mayor alcance de la que se presenta con dipolos inducidos.
Además de estas interacciones no covalentes, algunas proteínas oligoméricas estabilizan su estructura cuaternaria mediante un tipo de enlace covalente, el enlace disulfuro. Estos se establecen entre los grupos sulfhidrilo de las cisteínas de distintos protómeros.
Los enlaces disulfuro también ayudan a estabilizar la estructura secundaria de las proteínas, pero en este caso, unen los residuos cisteinilo dentro de un mismo polipéptido (enlaces disulfuro intrapolipeptídicos).
Como ya se señaló antes, en las proteínas que están conformadas por varias subunidades o protómeros, estas subunidades pueden ser similares (homotípicas) o diferentes (heterotípicas).
Las subunidades que conforman una proteína son cadenas polipeptídicas asimétricas. Sin embargo, en las interacciones homotípicas, estas subunidades pueden asociarse de distintas maneras logrando diversos tipos de simetría.
Los grupos que interaccionan de cada protómero generalmente están ubicados en posiciones distintas, por lo cual se denominan interacciones heterólogas. Las interacciones heterólogas entre las distintas subunidades, en ocasiones ocurren de tal manera que cada subunidad está torcida con respecto a la precedente, pudiendo lograrse una estructura helicoidal.
En otras ocasiones las interacciones se dan de tal manera que grupos definidos de subunidades se disponen alrededor de uno o varios ejes de simetría, en lo que se conoce como simetría punto – grupo. Cuando existen varios ejes de simetría, cada subunidad rota con respecto a su vecina 360°/n (donde n representa el número de ejes).
Entre los tipos de simetría que se obtienen de esta manera se encuentran por ejemplo, helicoidal, cúbica e icosaédrica.
Cuando interactúan dos subunidades mediante un eje binario, cada unidad rota 180° con respecto a la otra, alrededor de ese eje. Esta simetría es conocida como simetría C2. En ella, los sitios de interacción en cada subunidad son idénticos; en este caso no se habla de interacción heteróloga, sino de una interacción isóloga.
Si por el contrario, la asociación entre los dos componentes del dímero es heteróloga, entonces se obtendrá un dímero asimétrico.
No siempre las subunidades que interaccionan en una proteína son de la misma naturaleza. Existen proteínas que están formadas por doce o más subunidades distintas.
Las interacciones que mantienen la estabilidad de la proteína son las mismas que en las interacciones homotípicas, pero se obtienen por lo general moléculas completamente asimétricas.
La hemoglobina, por ejemplo, es un tetrámero que presenta dos pares de subunidades diferentes (α2β2).

- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3th edition. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper’s Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemestry. 5th edition. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. 2nd edition. Thieme.
- A. Lehninger (1978). Bioquímica. Ediciones Omega, S.A.
- L. Stryer (1995). Biochemestry. W.H. Freeman and Company, Nueva York.
