Rayos anódicos: concepto, descubrimiento, propiedades
¿Qué son los rayos anódicos?
Los rayos anódicos o rayos canales, también llamados positivos, son haces de rayos positivos constituidos por cationes atómicos o moleculares (iones con carga positiva) que se dirigen hacia el electrodo negativo en un tubo de Crookes.
Los rayos anódicos se originan cuando los electrones que van desde el cátodo hacia el ánodo, chocan con los átomos del gas encerrado en el tubo de Crookes.
Como las partículas del mismo signo se repelen, los electrones que van hacia el ánodo arrancan a su paso los electrones presentes en la corteza de los átomos de gas.
Así, los átomos que se han quedado cargados positivamente —es decir, se han transformado en iones positivos (cationes)— son atraídos hacia el cátodo (con carga negativa).
Descubrimiento
Fue el físico alemán Eugen Goldstein quien los descubrió, observándolos por primera vez en 1886.
Posteriormente, los trabajos realizados sobre los rayos anódicos por los científicos Wilhelm Wien y Joseph John Thomson acabaron suponiendo el desarrollo de la espectrometría de masas.
Propiedades de los rayos anódicos
Las principales propiedades de los rayos anódicos son las siguientes:
– Poseen carga positiva, siendo el valor de su carga múltiplo entero de la carga del electrón (1,6 ∙ 10-19 C).
– Se desplazan en línea recta en ausencia de campos eléctricos y campos magnéticos.
– Se desvían en presencia de campos eléctricos y campos magnéticos, desplazándose hacia la zona negativa.
– Pueden penetrar finas capas de metales.
– Pueden ionizar gases.
– Tanto la masa y como la carga de las partículas que conforman los rayos anódicos varía en función del gas encerrado en el tubo. Normalmente su masa es idéntica a la masa de los átomos o moléculas de las que derivan.
– Pueden provocar cambios físicos y químicos.
Un poco de historia
Previamente al descubrimiento de los rayos anódicos, tuvo lugar el descubrimiento de los rayos catódicos, el cual se produjo a lo largo de los años 1858 y 1859. El descubrimiento se debe a Julius Plücker, matemático y físico de origen alemán.
Posteriormente, fue el físico inglés Joseph John Thomson quien estudió en profundidad el comportamiento, las características y los efectos de los rayos catódicos.

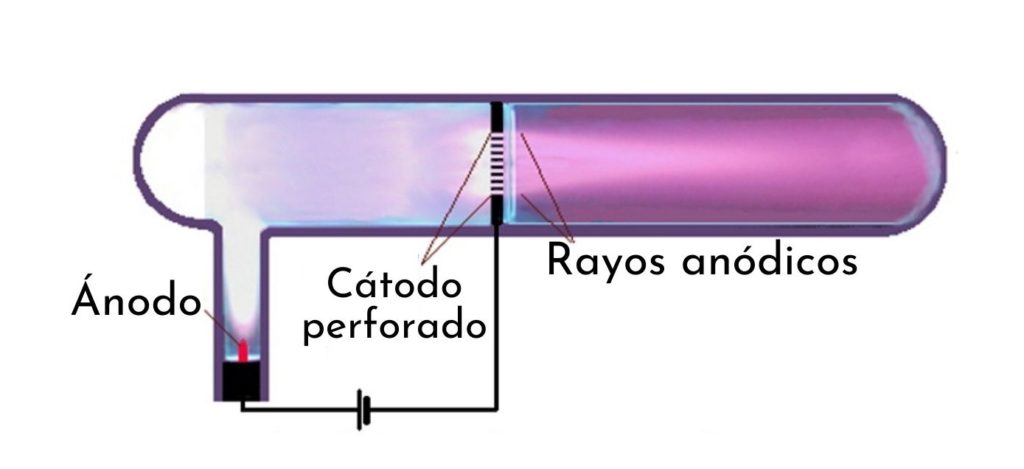
Por su parte, Eugen Goldstein —quien ya había realizado previamente otras investigaciones con los rayos catódicos— fue quien descubrió los rayos anódicos. El descubrimiento tuvo lugar en 1886 y lo realizó cuando se percató de que los tubos de descarga con el cátodo perforado también emitían luz al final del cátodo.
De este modo descubrió que, además de los rayos catódicos, existían otros rayos: los rayos anódicos; estos se desplazaban en la dirección contraria. Como estos rayos pasaban a través de los agujeros o canales en el cátodo, decidió llamarlos rayos del canal.
Sin embargo, no fue él, sino Wilhelm Wien quién más adelante realizó extensos estudios de los rayos anódicos. Wien, junto Joseph John Thomson, acabó estableciendo la base de la espectrometría de masas.
El descubrimiento de Eugen Goldstein sobre los rayos anódicos constituyó un pilar fundamental para el posterior desarrollo de la física contemporánea.
Gracias al descubrimiento de los rayos anódicos se dispuso por primera vez de enjambres de átomos en movimiento rápido y ordenado, cuya aplicación resultó muy fértil para distintas ramas de la física atómica.
El tubo de rayos anódicos
En el descubrimiento de los rayos anódicos, Goldstein utilizó un tubo de descarga que tenía perforado el cátodo. El proceso detallado por el cual se forman los rayos anódicos en un tubo de descarga de gas es el que se expone a continuación.
Al aplicar una gran diferencia de potencial de varios miles de voltios al tubo, el campo eléctrico que se crea acelera el pequeño número de iones que siempre está presente en un gas y que son creados por procesos naturales como la radiactividad.
Estos iones acelerados colisionan con los átomos del gas, arrancándoles electrones y creando más iones positivos. A su vez estos iones y electrones atacan nuevamente a más átomos, creando más iones positivos en lo que es una reacción en cadena.
Los iones positivos son atraídos por el cátodo negativo y algunos pasan a través de los agujeros en el cátodo. Cuando alcanzan el cátodo, ya se han acelerado a la velocidad suficiente como que para, cuando colisionen con otros átomos y moléculas del gas, exciten a las especies a niveles de energía más altos.
Cuando estas especies regresan a sus niveles de energía originales, los átomos y moléculas liberan la energía que habían ganado previamente; la energía es emitida en forma de luz.
Este proceso de producción de luz, denominado fluorescencia, provoca la aparición de un brillo en la región donde los iones emergen del cátodo.
El protón
Si bien Goldstein con sus experimentos con los rayos anódicos obtuvo protones, lo cierto es que no es a él a quien se le atribuye el descubrimiento del protón, ya que no fue capaz de identificarlo correctamente.
El protón es la partícula más ligera de las partículas positivas que se producen en los tubos de rayos anódicos. El protón se produce cuando el tubo está cargado con gas de hidrógeno. De esta forma, cuando el hidrógeno se ioniza y pierde su electrón, se obtienen los protones.
El protón tiene una masa de 1,67 ∙10-24 g, casi la misma que la del átomo de hidrógeno, y posee la misma carga pero de signo contrario que la que tiene el electrón; es decir, 1.6 ∙10-19 C.
Espectrometría de masas

La espectrometría de masas, desarrollada a partir del descubrimiento de los rayos anódicos, es un procedimiento analítico que permite estudiar la composición química de las moléculas de una sustancia con base en su masa.
Permite tanto reconocer compuestos no conocidos, contar compuestos que sean conocidos, así como conocer las propiedades y la estructura de las moléculas de una sustancia.
Por su parte, el espectrómetro de masas es un dispositivo con el cual se puede analizar de un modo muy preciso la estructura de diferentes compuestos químicos e isótopos.
El espectrómetro de masas permite separar los núcleos atómicos con base en la relación entre la masa y la carga.
