Óxido de cloro (V): propiedades, estructura, usos
El óxido de cloro (V) es un compuesto inorgánico altamente inestable cuya fórmula química es Cl2O5. Es uno de los tantos óxidos de cloro, los cuales se caracterizan por ser moleculares, o incluso, especies radicales.
El Cl2O5 sólo ha hallado vida en el papel y los cálculos teóricos; sin embargo, su existencia no se ha descartado y es probable que algún pueda ser caracterizado (por técnicas de espectroscopia avanzadas). Lo que por conceptos generales de química se puede predecir de este óxido, es que es el anhídrido del ácido clórico, HClO3.
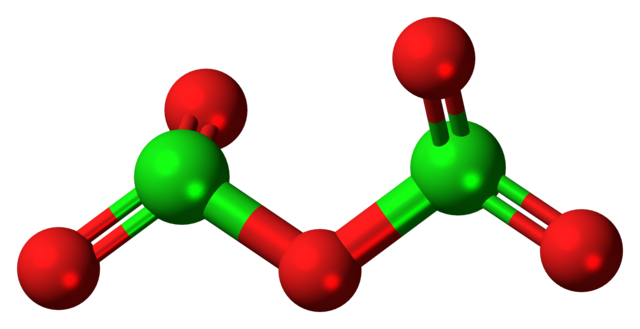
Arriba se muestra la hipotética molécula de óxido de cloro (V). Nótese que por tratarse de una molécula, no se considera en absoluto la presencia del ion Cl+5; aún menos cuando este debe tener un poder polarizante tal para obligar al oxígeno enlazarse covalentemente.
Como todo compuesto inestable, libera energía para descomponerse en productos más estables; proceso que en muchos casos es explosivo. Cuando el Cl2O5 se descompone libera ClO2 y O2. Se teoriza que en el agua, dependiendo de cuál sea el isómero de Cl2O5, puede formarse varios oxoácidos de cloro.
Índice del artículo
La masa molar del Cl2O5 es 150,9030 g/mol. A partir de esta masa, y de su hipotética molécula, puede conjeturarse que de poder aislarse sería probablemente un líquido aceitoso; claro está, comparándolo con la apariencia física del Cl2O7.
Aunque no pueda aislarse ni caracterizarse, este óxido de cloro es ácido, covalente y además debe de tener un momento dipolar pequeño. Su acidez es comprensible si se analiza la ecuación química de su hidrólisis:
Cl2O5 + H2O 2HClO3
Siendo el HClO3 el ácido clórico. La reacción inversa resultaría en el caso de que se pueda deshidratar el ácido:
2HClO3 => Cl2O5 + H2O
Por otro lado, cuando el Cl2O5 apenas se produce, se descompone:
2Cl2O5 => 4ClO2 + O2
Es por lo tanto una especie intermediaria en lugar de un óxido propiamente hablando. Su descomposición debe ser tan rápida (considerando que siquiera se forme el Cl2O5), que no ha podido ser detectado por las técnicas actuales de análisis instrumental.
En la imagen superior se mostró la estructura de la hipotética molécula de Cl2O5 con un modelo de esferas y barras. Las esferas rojas representan a los átomos de oxígeno, y las verdes a los del cloro. Cada cloro tiene un entorno pirámide trigonal, por lo que su hibridación debe de ser sp3.
Así, la molécula de Cl2O5 puede ser vista como dos pirámides trigonales unidas por un oxígeno. Pero si se observa cuidadosamente, una pirámide orienta sus átomos de oxígeno hacia abajo, y la otra hacia fuera del plano (en dirección al lector).
De aquí se presume que existan rotaciones en el enlace O2Cl-O-ClO2, haciendo que la molécula sea relativamente dinámica. Nótese que la fórmula O2ClOClO2 es una manera de representar la estructura del Cl2O5.
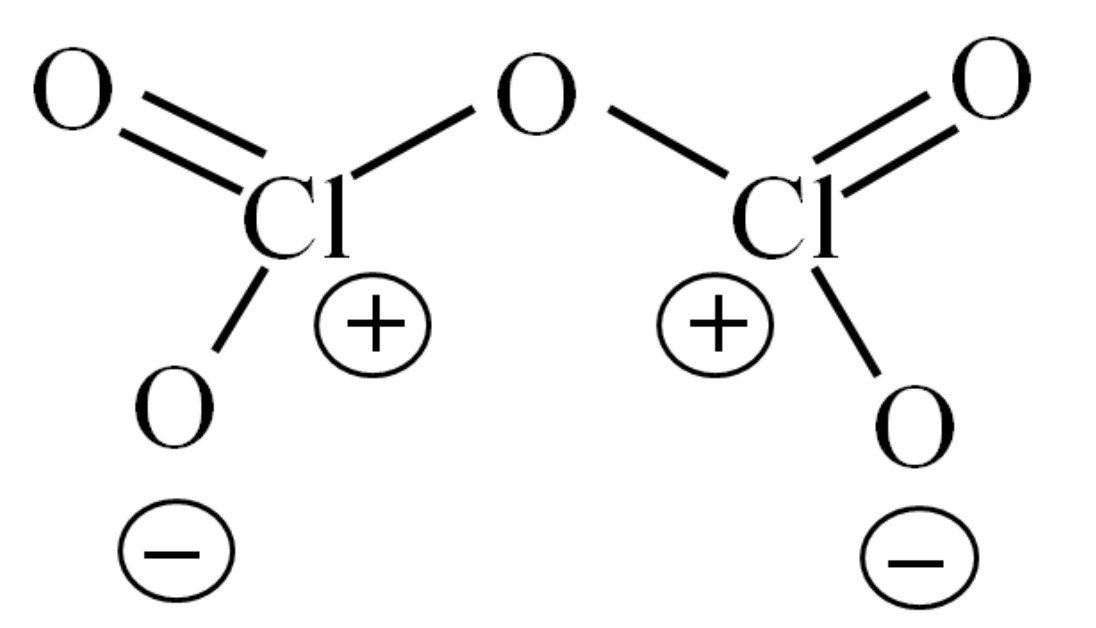
Hasta ahora la molécula por sí misma no ha permitido descifrar a qué se debe su inestabilidad. Para arrojar luz a esta interrogante, se recurre a su estructura de Lewis, representada arriba. Nótese que puede pensarse equivocadamente que la estructura sea plana, pero en el subapartado anterior se aclaró que no es así.
¿Por qué ambos átomos de cloro tienen cargas formales positivas? Porque al cloro le queda un par libre de electrones, lo cual puede comprobarse al aplicársele la Teoría de Enlace de Valencia (que por motivo de simplificación no se hará aquí). Así, su carga formal es:
Cf = 7 – (4 + 2) = 1
¿Y qué tiene que ver esto con su inestabilidad? Pues que el cloro es considerablemente electronegativo, y por tanto un mal portador de cargas formales positivas. Esto vuelve al Cl2O5 una especie sumamente ácida, ya que necesita ganar electrones para surtir la demanda electrónica de los dos cloros.
Lo contrario sucede con el Br2O5 y el I2O5, óxidos que sí existen en condiciones normales. Esto se debe a que tanto el bromo como el yodo son menos electronegativos que el cloro; y por lo tanto, soportan mejor la carga formal positiva.
Hasta ahora toda la explicación ha recaído en uno de los dos isómeros del Cl2O5: el O2ClOClO2. ¿Cuál es el otro? El O3ClOClO. En este isómero los cloros carecen de cargas formales positivas, y deberían por ende ser una molécula más estable. No obstante, tanto el O2ClOClO2 como el O3ClOClO deberían sufrir reacciones de hidrólisis:
O2Cl-O-ClO2 + H2O => 2O2Cl-OH (los cuales no son más que el HClO3)
O3Cl-O-ClO + H2O => O3Cl-OH (HClO4) + HO-ClO (HClO2)
Nótese que pueden formarse hasta tres oxoácidos de cloro: HClO3, HClO4 y HClO2
Su nombre ‘óxido de cloro (V)’ corresponde al asignado de acuerdo a la nomenclatura stock. El Cl2O5 puede asimismo tener otros dos nombres: pentaóxido de dicloro y anhídrido clórico, asignados por las nomenclaturas sistemática y tradicional, respectivamente.
Más que el de motivar estudios computacionales, el Cl2O5 carecerá de uso hasta que sea descubierto, aislado, caracterizado, almacenado y haya demostrado que no explote al menor contacto.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Sandra Luján Quiroga and Luis José Perissinotti. (2011). Chlorine Oxoacids and Structure of Dichlorine Oxides. Chem. Educator, Vol. 16.
- Formulación Química. (2019). Óxido de cloro (V). Recuperado de: formulacionquimica.com
- Linus Pauling. (1988). General Chemistry. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Encyclopedia of the Alkaline Earth Compounds. ElSevier.
