Indicadores de pH: qué son, tipos y cómo funcionan
¿Qué son los indicadores de pH?
Los indicadores de pH son sustancias que sirven para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Asimismo, se mide en una escala logarítmica negativa entre 0 y 14, donde las soluciones con pH menores a 7 se consideran ácidas, las de pH mayores a 7 son básicas y las de pH igual a 7 se consideran soluciones neutras. Este parámetro se expresa de la siguiente manera con la ecuación de Henderson-Hasselbalch: pH = pKa + log10 ([A–]/[HA]).
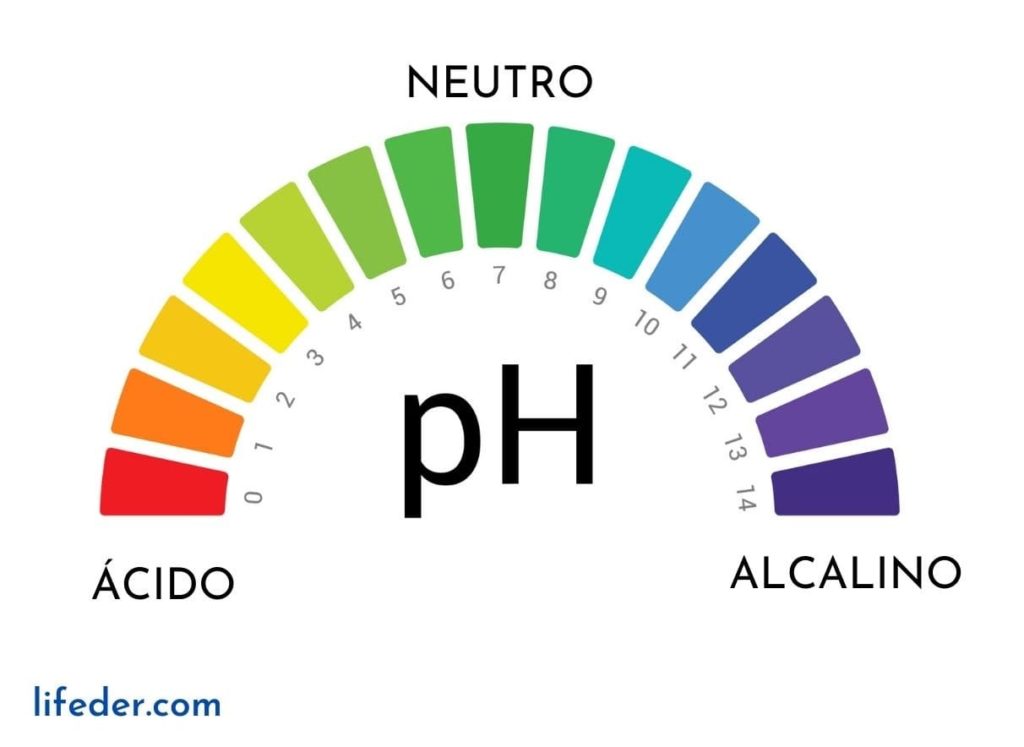
En la expresión anterior, el pKa representa el logaritmo negativo de la constante de disociación de ácidos, y las concentraciones molares [A–] y [HA] son las del ácido débil y su base conjugada, respectivamente. Conocer el pH permite estudiar la calidad del agua y los alimentos, y poder mantener la repetibilidad de un producto químico elaborado.
Tipos de indicadores
Existen tres tipos principales de indicadores de pH:
- Indicadores líquidos ácido-base, que funcionan según un rango determinado de pH.
- Los papeles, tiras y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie.
- Los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
Indicadores líquidos

Los indicadores líquidos son ácidos o bases orgánicas débiles que poseen colores variantes según su forma ácida o básica. Estos trabajan dentro de rangos limitados, variando de color una vez se alcanza este, y dejando de variar el color cuando se alcanza el nivel máximo del rango.
Para que funcionen deben ser usados únicamente en soluciones donde se pueda observar un cambio de color (preferiblemente incoloras).
Existe un gran número de indicadores líquidos de distintos colores y rangos de pH, incluyendo el rojo de cresol (rojo a amarillo en un rango de 0,2 a 1,8), el rojo de metilo (rojo a amarillo en un rango de 4,2 a 6,2), verde bromocresol (rosado a azul/verde de 4,2 a 5,2), y la fenolftaleína (incolora a rosada en un rango de 8,0 a 10,0).
Estos indicadores son populares para las titulaciones en la química analítica, aunque se debe tener cierto nivel de entrenamiento para llevar a cabo esta práctica de manera precisa.
Papeles indicadores o tiras

Existen varios tipos de papeles utilizados para la medición del pH, pero el más conocido es el llamado papel tornasol, el cual es elaborado con un polvo que proviene de líquenes.
El papel tornasol sirve para conocer si una solución líquida o gaseosa es ácida o básica (sin saber cuál será su pH exacto o un estimado del mismo), y viene en dos presentaciones: azul y rojo.
El papel tornasol azul cambia a rojo en condiciones ácidas, y el papel tornasol rojo cambia a azul en condiciones básicas o alcalinas, pudiendo reciclarse para realizar la prueba de manera inversa una vez el papel ya haya cambiado el color.
Las limitaciones conocidas del papel —como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos— ha hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros
Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos.
Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
El funcionamiento de estos medidores de pH se explica con más profundidad en la sección siguiente, pero en general estos indicadores se consideran los más precisos por excelencia, brindando un número preciso (a la exactitud de 0,01 unidades de pH) del parámetro y contando con una sensibilidad y rapidez superior a los otros dos métodos.
Además, también pueden medir otras características, como sólidos disueltos, conductividad eléctrica y temperatura de la solución.
La única desventaja de este tipo de medidores de pH es que son equipos delicados y, además de una calibración inicial que debe realizar un instrumentista o conocedor del equipo, también necesitarán ser limpiados regularmente para evitar que los electrodos sufran acumulación de material en estos.
¿Cómo funcionan los indicadores de pH?
Indicadores líquidos
Los indicadores líquidos cambian de color por acción de la protonación o desprotonación en su estructura (dependiendo de la naturaleza básica o ácida del indicador), la cual se basa en el equilibrio de la reacción, así: HIn + H2O ↔ H3O+ + In–
Es decir, que una vez agregado el indicador a la solución, si el equilibrio de este medio comienza a tender al sentido opuesto por aumento o disminución del ión hidronio (de nuevo, dependiendo de la naturaleza del indicador), este cambiará de color hasta finalmente quedarse de un color nuevo invariable.
Papeles indicadores
Los papeles indicadores, en específico el papel tornasol, deben entrar en contacto con la solución a analizar de manera discreta para poder medir con precisión.
Es decir, en una solución líquida este no debe ser introducido por completo en ella, sino que deberá ser goteado con esta o tocar brevemente una muestra de la sustancia.
En el caso de una solución gaseosa, el gas debe pasar sobre la superficie del papel para permitir que haga contacto y este cambie de color.
pH-metros
Los pH-metros funcionan por la diferencia eléctrica potencial entre un electrodo de pH y uno de referencia.
El pH-metro mide el voltaje que existe entre dos electrodos en una solución y muestra el resultado convertido en un valor de pH correspondiente.
El equipo en sí consiste en un par de electrodos —uno de los cuales es metálico e insensible al pH de la solución— y un amplificador electrónico sencillo. Para su calibración, el equipo es calibrado con soluciones de pH conocido.
