Inmunofluorescencia: fundamento, protocolo y aplicaciones
La inmunofluorescencia es una poderosa técnica de inmunomarcaje que utiliza anticuerpos unidos covalentemente a moléculas fluorescentes para identificar blancos específicos en muestras celulares fijadas sobre un soporte sólido.
Esta técnica la observación microscópica con la especificidad inmunológica, haciendo posible la observación de células vivas o muertas que pueden presentar minúsculas cantidades de antígenos. Es ampliamente utilizada tanto en el campo de la investigación como en el diagnóstico clínico de diversas patologías.
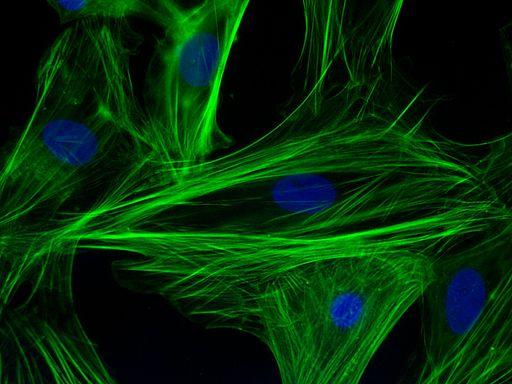
Esta técnica, principalmente cualitativa (con algunas variantes cuantitativas), tiene que ver específicamente con la visualización de una muestra por la señal producto de un fluoróforo, que es una molécula fluorescente unida a un anticuerpo y que es capaz de excitarse a determinada longitud de onda.
En el contexto celular resulta de gran utilidad para estudiar la presencia/ausencia y ubicación subcelular de proteínas. La técnica fue empleada en sus inicios en el ámbito clínico para el diagnóstico de virus como la influenza y subsecuentemente para el de muchas otras enfermedades infecciosas.
Es una técnica de gran sensibilidad, y con el equipo adecuado de microscopía, puede tener muy buena resolución. Requiere, para su observación, del uso de microscopios confocales o de epifluorescencia.
No obstante, pese a ser muy popular, puede presentar algunos problemas importantes respecto a la obtención de fluorescencia inespecífica que genera cierto “ruido” de fondo, lo que limita muchas veces la lectura adecuada de los resultados.
Índice del artículo
La inmunofluorescencia se basa en la explotación del fenómeno biológico de la reacción de interacción entre un anticuerpo y un antígeno. Tiene que ver concretamente con la visualización o detección de esta reacción al excitar las moléculas fluorescentes a una longitud de onda específica.
Un anticuerpo es una proteína inmunoglobulina secretada a partir de células B activas, y que es generado específicamente contra un antígeno, al cual puede unirse con gran afinidad y especificidad. La inmunofluorescencia hace uso de las inmunoglobulinas IgG, que se encuentran de forma soluble en el suero sanguíneo.
Los anticuerpos son moléculas de hasta 950 kDa compuestas por dos cadenas peptídicas cortas (ligeras) y dos largas en forma de “Y” (pesadas). Tanto las cadenas ligeras como las pesadas se dividen en dos dominios: uno variable, capaz de reconocer el antígeno, y otro constante o conservado, característico de cada especie.
Los antígenos se definen funcionalmente como las moléculas que pueden ser reconocidas por un anticuerpo y son, en su mayoría, proteínas. Cuando un animal es expuesto a un antígeno, los linfocitos del sistema inmune se activan, produciendo anticuerpos específicos contra este y que funcionan como sistema de defensa.
Un antígeno, como una proteína, por ejemplo, puede tener más de un epítope o lugar de reconocimiento por un anticuerpo, por lo que el suero del animal expuesto a un antígeno puede tener anticuerpos policlonales contra diferentes regiones de la misma proteína.
La inmunofluorescencia, entonces, explota la capacidad de un animal para producir anticuerpos policlonales contra un antígeno específico en aras de purificarlo y emplearlo posteriormente para la detección del mismo antígeno en otros contextos.
Entre los tintes o moléculas fluorescentes más empleados para algunas técnicas de inmunofluorescencia están el isotiocianato de fluoresceína (FITC), el isotiocianato de tetrametilrodamina-5 y 6 (TRITC), muchas cianinas como Cy2, Cy3, Cy5 y Cy7 y tintes denominados Alexa Fluor®, como el Alexa Fluor®448.
El protocolo de inmunofluorescencia varía en dependencia de muchos factores, sin embargo y en líneas generales, engloba una secuencia lineal de pasos que consisten en:
- Preparación de las láminas y de las células
- Fijación de las muestras
- Permeabilización
- Bloqueo
- Inmunotinción o inmunomarcaje
- Montaje y observación
De las muestras
La preparación de las muestras dependerá de su naturaleza y del tipo de experiencia a realizar. A continuación, se explicará el caso más sencillo, que implica el uso de células en suspensión.
Las células en suspensión, es decir, en un medio de cultivo líquido, deben primero separarse de este por centrifugación y luego deben ser lavadas con una solución tampón o “buffer” isosmótico, que preserve su integridad.
Normalmente se emplea un tampón fosfato-salino conocido como PBS, en el que se resuspenden las células y esta mezcla vuelve a centrifugarse para obtener las células libres del medio de cultivo, que puede tener sustancias interferentes.
De las láminas
Las láminas empleadas para la observación microscópica, donde posteriormente serán fijadas las células para los tratamientos correspondientes aguas abajo, también deben ser preparadas cuidadosamente.
Estas son cubiertas o “sensibilizadas” con una solución de poli-lisina, un polímero sintético que hará las veces de “pegamento molecular” entre las células y el soporte sólido, gracias a la interacción electrostática entre las cargas positivas de sus grupos amino y las cargas negativas de las proteínas que recubren a las células.
Este proceso consiste en inmovilizar las proteínas que se encuentran en el interior celular con la finalidad de mantener intacta su ubicación espacial. Las moléculas que se emplean deben ser capaces de atravesar todos los tipos de membranas celulares y de formar entramados con las proteínas covalentes.
Son muy utilizados el formaldehído y paraformaldehído, el glutaraldehído e incluso el metanol, con el cual se incuban las muestras celulares por un tiempo determinado para luego lavarlas con una solución tampón de carácter isosmótico.
Después de la fijación de las células se prosigue a unirlas a las láminas previamente sensibilizadas con poli-lisina.
Dependiendo del tipo de ensayo que se realice será necesario permeabilizar o no las células en estudio. Si lo que se busca es conocer la ubicación, presencia o ausencia, de determinada proteína en la superficie celular, la permeabilización no será necesaria.
En cambio, si se quiere conocer la localización de una proteína en el interior celular, la permeabilización es indispensable y consistirá en incubar las muestras con Tritón X-100, un detergente capaz de permeabilizar las membranas celulares.
Un paso fundamental en todas las técnicas inmunológicas es el bloqueo. En esta etapa del procedimiento, el bloqueo consiste en cubrir, en las láminas sensibilizadas, todos los sitios con moléculas de poli-lisinas a los que no se adhirieron células. Es decir, previene cualquier unión inespecífica.
Normalmente para el bloqueo se utilizan soluciones con albúmina de suero bovina (BSA) en tampón PBS y los mejores resultados se obtienen mientras más largo es el tiempo de incubación con esta solución. Tras cada paso, incluyendo el del bloqueo, es menester remover mediante lavados la solución remanente.
El procedimiento de inmunotinción o inmunomarcaje dependerá principalmente si se trata de una inmunofluorescencia directa o indirecta (ver más adelante).
Si se trata de una inmunofluorescencia primaria o directa, las muestras se incubarán con los anticuerpos deseados, que deberán están acoplados a los tintes fluorescentes. El procedimiento de incubación consiste en hacer una dilución del anticuerpo en una solución que también contendrá BSA pero en una menor proporción.
Cuando el caso es el de una inmunofluorescencia secundaria o indirecta deben realizarse dos incubaciones consecutivas. Primero con los anticuerpos deseados y luego con los anticuerpos que son capaces de detectar las regiones constantes de las inmunoglobulinas primarias. Son estos anticuerpos secundarios los que están unidos covalentemente a los fluoróforos.
La técnica resulta muy versátil, permitiendo hacer marcajes simultáneos de más de un antígeno por muestra, siempre y cuando se tengan anticuerpos primarios acoplados a diferentes fluoróforos, en el caso de la inmunofluorescencia directa.
Para los marcajes simultáneos en la inmunofluorescencia indirecta es necesario asegurarse de que cada anticuerpo primario sea producido en un animal diferente, así como también de que cada anticuerpo secundario esté acoplado a un fluoróforo distinto.
Al igual que el bloqueo, la incubación con los anticuerpos da mejores resultados mientras mayor sea el tiempo de esta. Después de cada paso es necesario lavar el exceso de anticuerpos que no se unieron a las muestras y en la inmunofluorescencia secundaria es necesario bloquear antes de añadir el anticuerpo secundario.
Ciertas técnicas emplean otros tintes que no tienen que ver con inmunomarcaje, como por ejemplo la tinción del ADN nuclear con el fluoróforo DAPI.
Durante el tiempo de incubación final con los fluoróforos es necesario que las muestras permanezcan en la oscuridad. Para la observación al microscopio es común emplear algunas sustancias para la preservación de la fluorescencia de los fluoróforos acoplados a los anticuerpos.
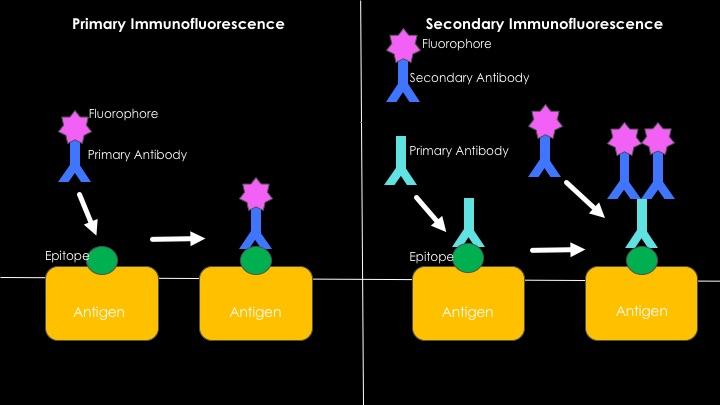
Tiene que ver con la detección de antígenos mediante el uso de anticuerpos fluorescentes. La ventaja principal del empleo de esta técnica es su rapidez, sin embargo, muchos casos de unión inespecífica pueden darse en el proceso, particularmente al estudiar sueros humanos, pues son ricos en anticuerpos muy heterogéneos.
Se conoce también como la técnica de “sándwich” y esta implica el desarrollo de la técnica en dos pasos. El primero tiene que ver con el empleo de un anticuerpo no fluorescente y su unión al antígeno de interés.
Contra la región constante de este primer anticuerpo (que ahora servirá de antígeno) se utiliza un segundo anticuerpo capaz de reconocerlo, que sí está asociado a una molécula fluorescente.
La aparición de una señal fluorescente será el resultado del reconocimiento específico entre el primer anticuerpo no fluorescente y el antígeno de interés; la presencia de ese primer anticuerpo condiciona la del segundo, que sí está etiquetado y gracias al cual podrá determinarse la presencia o ausencia del antígeno.
A pesar de ser una técnica que consume mucho más tiempo que la inmunofluorescencia directa (pues incluye un paso más de incubación), esta técnica no implica el diseño de un anticuerpo fluorescente por cada antígeno que se estudia, lo que resulta, en términos económicos, más viable.
Además, es una técnica más sensible en términos de amplificación de señal, puesto que más de un anticuerpo secundario puede unirse a la región constante del anticuerpo primario, amplificando así la intensidad de la señal fluorescente.
Como pudo haberse notado anteriormente, la inmunofluorescencia es una técnica sumamente versátil, a la cual se han dado multiplicidad de usos en el ámbito científico y clínico. Puede ser utilizada para responder preguntas ecológicas, genéticas y fisiológicas respecto a muchos organismos.
Entre las aplicaciones clínicas se emplea para el diagnóstico directo de algunas enfermedades dermatológicas, bien sea empleando inmunofluorescencia directa o indirecta sobre tejido epitelial de los pacientes estudiados.
Se ha dispuesto de las técnicas de inmunofluorescencia en organismos unicelulares como las levaduras para visualizar los microtúbulos intranucleares y citoplasmáticos, actina y proteínas asociadas, los filamentos de 10nm y otros constituyentes del citoplasma, de la membrana y las paredes celulares.
- Abcam, Immunocytochemistry and immunofluorescence protocol. Retrieved from abcam.com
- Greph, C. (2012). Fluorescent Dyes. Retrieved from leica-microsystems.com
- Miller, D. M., & Shakest, D. C. (1995). Immunofluorescence Microscopy. In Methods in Cell Biology (Vol. 48, pp. 365–394). Academic Press, Inc.
- Odell, I. D., & Cook, D. (2013). Immunofluorescence Techniques. Journal of Investigative Dermatology, 133, 1–4.
- Princle, B. J. R., Adams, A. E. M., Druain, D. G., & Brian, K. (1991). Immunofluorescence methods for yeast. In Methods of Enzymology (Vol. 194, pp. 565–602). Academic Press, Inc.
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Applications of immunofluorescence in Public Health Virology. Bacteriological Reviews, 28(4), 402–408.
- Vrieling, E. G., & Anderson, D. M. (1996). Immunofluorescence in phytoplankton research: applications and potential. J: Phycol., 32, 1–16.
