Cadena transportadora de electrones: componentes, secuencia, inhibidores
La cadena transportadora de electrones consiste en un conjunto de moléculas proteicas y coenzimas dentro de una membrana. Como su nombre lo indica, se encarga del transporte de electrones desde las coenzimas NADH o FADH2 hasta el receptor final que es O2 (oxígeno molecular).
En este proceso de transporte, la energía liberada al transferirse los electrones desde las coenzimas hasta el oxígeno molecular mediante centros redox unidos a proteínas, esta asociada a la producción de energía (ATP). Dicha energía se obtiene gracias al gradiente de protones que se genera en la membrana interna mitocondrial.
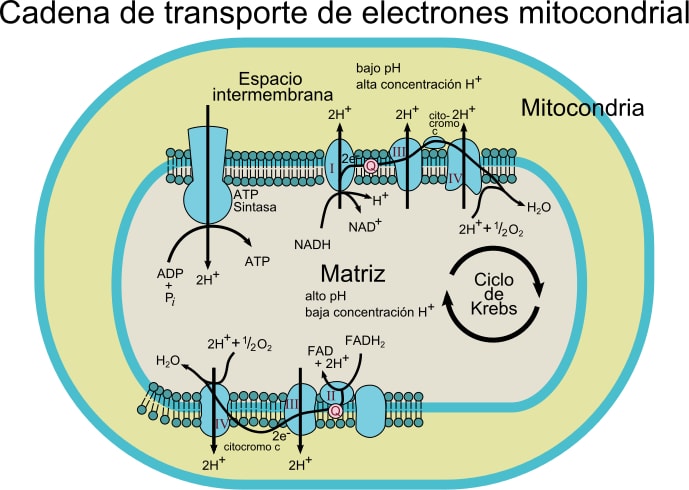
Este sistema de transporte se compone de diversos componentes que pueden hallarse en al menos, dos estados de oxidación. Cada uno de ellos es eficazmente reducido y reoxidado durante el movimiento de los electrones desde NADH o FADH2 hasta el O2.
Las coenzimas NAD+ y FAD son reducidas en las rutas de oxidación de ácidos grasos y el ciclo del ácido cítrico como consecuencia de la oxidación de diversos sustratos. Posteriormente dichas coenzimas son oxidadas en la cadena de transporte electrónico.
De modo que el sistema de transporte electrónico consiste en una secuencia de reacciones de óxido-reducción que se encuentran conectadas entre sí.
Índice del artículo
- 1 Componentes de la cadena
- 2 Secuencia del transporte de electrones
- 3 Los complejos de la cadena son independientes
- 4 Inhibidores de la cadena de transporte electrónico
- 5 Referencias
Dependiendo del tipo de organismo se pueden observar de 3 a 6 componentes constituyendo la cadena transportadora de electrones. El proceso de transporte de electrones y la síntesis de ATP por la fosforilación oxidativa, son procesos que ocurren en una membrana.
En el caso de las células procariotas (bacterias aeróbicas), dichos procesos suceden asociados a la membrana plasmática. En las células eucariotas ocurre en la membrana mitocondrial, por lo que los componentes del transporte de electrones se encuentran en la parte interna de la membrana.
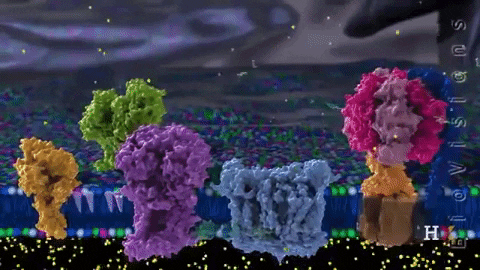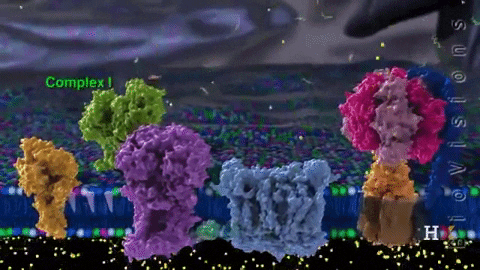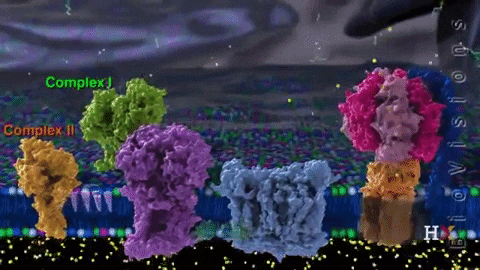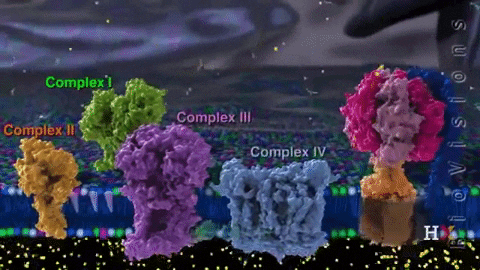
Los electrones son transferidos de forma paulatina a través de cuatro complejos que componen la cadena de transporte electrónico.
Cada complejo cuenta con varios componentes proteicos asociados a grupos prostéticos (componentes no aminoacídicos de proteínas conjugadas) redox, que permiten que sus potenciales de reducción aumenten.
Además, este sistema de transporte está compuesto por diversas especies moleculares como flavoproteínas; coenzima Q también llamada ubiquinona (CoQ o UQ); diversos citocromos como citocromo b, c, c1, a y a3; proteínas con grupos Fe-S y proteínas unidas a Cu. Estas moléculas se vinculan a la membrana, con excepción del citocromo c.
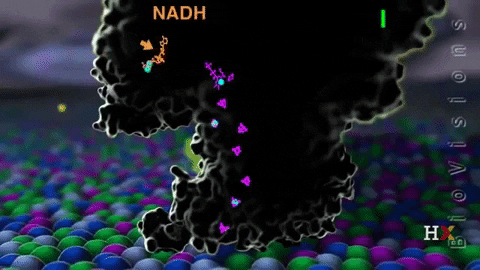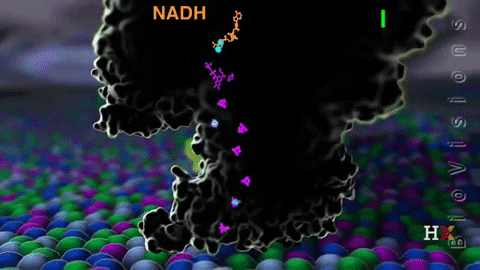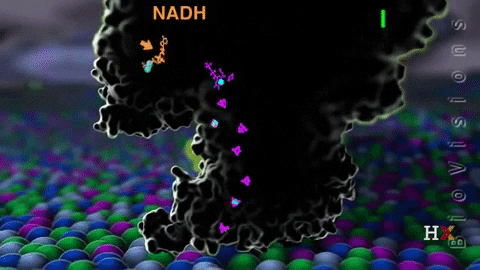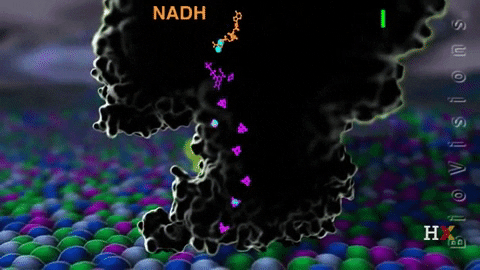
El complejo I llamado NADH coenzima quinona oxidoreductasa, o NADH deshidrogenasa, se compone de alrededor de 45 cadenas de polipéptidos y contiene una molécula de flavina mononucleótido (FMN) y de ocho a nueve agrupamientos Fe-S. Como su nombre lo indica, este complejo transfiere un par de electrones desde la coenzima NADH hasta CoQ.
La función del complejo NADH deshidrogenasa comienza con la unión del NADH a dicho complejo por el lado de la matriz de la membrana mitocondrial interna. Los electrones son luego transportados desde NADH hasta la FMN. Posteriormente, los electrones pasan desde la flavina reducida (FMNH2) hasta las proteínas con Fe-S.
La FMNH2 funciona como una especie de puente entre el NADH y las proteínas Fe-S, ya que estas últimas solo pueden transferir un solo electrón, mientras que la coenzima NADH transfiere dos, de modo que las flavinas realizan esta transferencia de un único electrón gracias a su estado redox de semiquinona.
Finalmente, los electrones son transferidos desde los agrupamientos Fe-S a la coenzima Q, que es un transportador móvil de electrones con una cola isoprenoide que lo vuelve hidrofóbico permitiéndole atravesar el centro de la membrana mitocondrial.

El complejo II, mejor conocido como succinato deshidrogenasa, es una proteína integral de la membrana interna mitocondrial, y es una enzima que interviene en el ciclo del ácido cítrico.
Este complejo se compone de dos subunidades hidrofílicas y dos hidrofóbicas con grupos hemo b que proveen el sitio de unión para la CoQ, además de una flavoproteína y una proteína con Fe-S.
En el ciclo del ácido cítrico (Ciclo de Krebs o de ácido tricarboxílico), el succinato es convertido a fumarato por la succinato deshidrogenasa, reduciendo la coenzima FAD a FADH2. Desde esta última coenzima, los electrones se transfieren a los centros Fe-S que a su vez los transfieren a la CoQ.
Durante las reacciones de esta transferencia de electrones, el potencial redox estándar es muy bajo, lo que impide que se libere la energía libre necesaria para sintetizar ATP.
Esto significa, que el complejo II es el único complejo de la cadena de transporte de electrones incapaz de proveer energía para la síntesis de ATP. Sin embargo, dicho complejo es clave en el proceso, puesto que transfiere los electrones desde FADH2 al resto de la cadena.
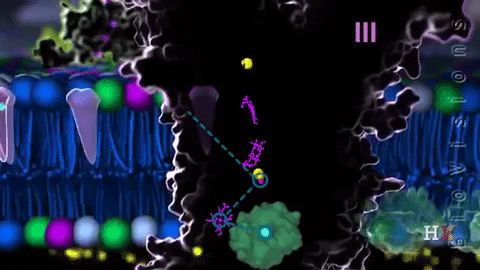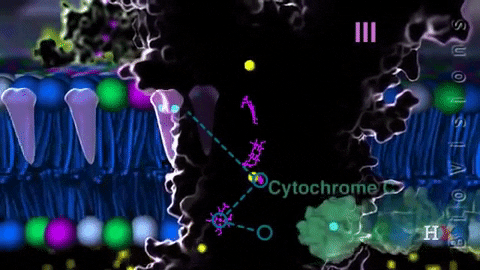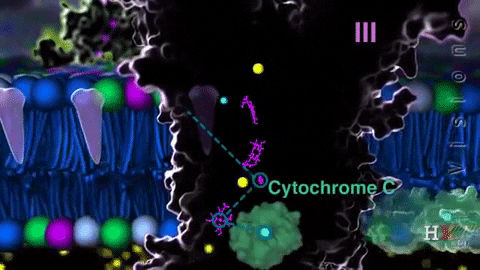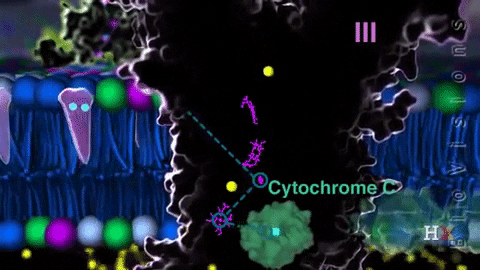
El complejo III, complejo citocromo bc1 o CoQ citocromo c reductasa, transfiere los electrones desde la coenzima Q reducida hasta el citocromo c. Dicha transferencia ocurre a través de una única vía redox, que se conoce como el ciclo Q.
Este complejo se compone de una proteína con Fe-S y tres citocromos diferentes, en los que el átomo de hierro ubicado en el grupo hemo varía cíclicamente entre los estados reducido (Fe2+) y oxidado (Fe3+).
Los citocromos son hemoproteínas de transporte electrónico, que poseen actividad redox. Están presentes en todos los organismos, a excepción de algunos anaerobios obligados.
Dichas proteínas poseen grupos hemo que se alternan entre dos estados de oxidación (Fe2+ y Fe3+). El citocromo c es un transportador móvil de electrones asociada débilmente a la membrana interna de las mitocondrias.
Los citocromos encontrados en este complejo son los citocromos b, c y a, los 3 son proteínas redox activas con grupos hemos con diferentes características, que alternan sus estados de oxidación entre Fe2+ y Fe3+.
El citocromo c es una proteína periférica de membrana que funciona como “lanzadera” de electrones con citocromo c1 y con el complejo IV.
El citocromo c y el O2 son los receptores finales de los electrones derivados de la oxidación de material orgánico, por lo que el complejo IV o citocromo c oxidasa es la enzima terminal en el proceso de transporte electrónico. Este acepta los electrones desde el citocromo c y los transfiere hacia la reducción de O2.
La función del complejo es catalizar oxidaciones de un electrón de las cuatro moléculas consecutivas de citocromo c reducido, es decir, reduce simultáneamente cuatro electrones de una molécula de O2, produciendo finalmente dos moléculas de H2O.
Los electrones se transfieren desde los complejos I y II hasta el complejo III gracias a la coenzima Q, y desde allí pasan al complejo IV por medio del citocromo c. Al pasar los electrones por estos cuatro complejos aumentan el potencial de reducción, liberando energía, que es luego usada para la síntesis de ATP.
En total, la transferencia de un par de electrones provoca la translocación de 10 protones a través de la membrana; cuatro en los complejos I y IV y dos del complejo III.
Esta enzima cataliza la oxidación de la coenzima NADH por la coenzima Q. Los electrones se mueven desde el NADH hasta el FMN que esta unido a la cola hidrofílica del complejo I. Los agrupamientos de Fe-S transfieren a los electrones de uno por vez. Dichos grupos Fe-S reducen a la CoQ, que esta embebida en la membrana, hasta ubiquinol (CoQ reducida).
Durante la transferencia de los electrones hasta la CoQ, cuatro protones son a su vez transferidos a través de la membrana interna, hasta el espacio intermembranal. El mecanismo por el que son translocados dichos protones involucra proteínas localizadas en la cola hidrofóbica del complejo I.
El proceso de transferencia de los electrones en este paso libera energía libre, específicamente -16,6 kcal/mol.
La coenzima Q es oxidada por el citocromo c, en una reacción catalizada por esta coenzima. La oxidación del ubiquinol (CoQ reducido) ocurre en un determinado sitio del complejo (Qo o sitio de oxidación) en la membrana mitocondrial, transfiriendo dos electrones, uno a la proteína con los grupos Fe-S y otro a los grupos hemo.
En el ciclo Q, la oxidación de CoQ produce semiquinona, que es de donde se trasladan los electrones hasta los grupos hemo b1 y bh. Mientras esta transferencia de electrones ocurre, una segunda CoQ se oxida en el sitio Qo, repitiéndose el ciclo.
Este ciclo provoca la transferencia de dos electrones y a su vez la translocación de cuatro protones al espacio intermembranal, con la liberación de -10,64 kcal/mol de energía libre.
Esta enzima (complejo IV) cataliza la oxidación del citocromo c (reducido) por el O2, que es el aceptor final de electrones. Esta transferencia produce una molécula de H2O por cada par de electrones transferido además de la translocación de protones a través de la membrana.
Los electrones se desplazan de uno en uno, desde el citocromo c reducido hasta un par de iones CuA, luego pasan a un grupo hemo a y finalmente llegan al centro binuclear del complejo que contiene iones CuB y hemo a3, donde ocurre la transferencia de cuatro electrones hasta el oxígeno.
En el complejo IV los elementos transfieren los electrones de uno en uno, de manera que el O2 se reduce de forma paulatina, de manera que no ocurre la liberación de algunos compuestos tóxicos como el superóxido, peróxido de hidrógeno o radicales hidroxilos.
La energía liberada en esta etapa corresponde a -32 kcal/mol. El gradiente electroquímico generado durante el proceso de transferencia y los cambios de energía (ΔE) ocasionados por un par de electrones al pasar por los cuatro complejos, corresponde, en cada etapa, a la energía libre necesaria para la producción de una molécula de ATP.
Como se ha mencionado, este complejo tiene la única pero importante función de introducir los electrones del FADH2 desde el ciclo del ácido cítrico a la cadena transportadora de electrones.
Esta enzima cataliza la oxidación de la coenzima FADH2 por la coenzima Q (oxidada). En el ciclo del ácido cítrico al oxidarse el succinato a fumarato, dos electrones y dos protones se transfieren al FAD. Posteriormente el FADH2 transfiere estos electrones hasta CoQ a través de los centros Fe-S del complejo.
Finalmente, desde la CoQ los electrones se transfieren al complejo III, siguiendo los pasos descritos anteriormente.
Los cuatro complejos que conforman la cadena de transporte electrónico son independientes, es decir, se encuentran y operan de forma independiente en la membrana interna mitoconcrial, y el movimiento de cada uno de ellos en la membrana no depende ni esta ligado con los demás complejos.
Los complejos I y II se desplazan en la membrana transfiriendo sus electrones a CoQ que se difunde también en la membrana y los transfiere hasta el complejo III, desde donde pasan los electrones al citocromo c que también resulta móvil en la membrana y deposita los electrones en el complejo IV.
Sobre la cadena de transporte electrónico actúan algunos inhibidores específicos que interfieren en su proceso. La Rotenona es un insecticida usado comúnmente que se une estequiométricamente al complejo I, evitando la reducción de la CoQ.
Algunos fármacos de tipo barbitúricos como Piericidina y Amytal, inhiben al complejo I, interfiriendo en la transferencia de los electrones desde los grupos Fe-S a la CoQ.
En el complejo II algunos compuestos como el thenoiltrifluoroacetona y el malonato actúan como inhibidores competitivos con el succinato, evitando su oxidación y a su vez la transferencia de electrones al FAD.
Algunos antibióticos como myxotiazol y stigmatellin, se unen a los sitios Q de unión de la CoQ, inhibiendo la transferencia de los electrones desde la coenzima Q hasta los centros Fe-S de las proteínas.
El cianuro, la azida (N3-), el ácido sulfúrico, y el monóxido de carbono inhiben al complejo IV. Estos compuestos se unen a los grupos hemo, evitando la transferencia de los electrones al centro binuclear del complejo o al oxígeno (O2).
Al inhibirse la cadena transportadora de electrones, se detiene la producción de energía por la fosforilación oxidativa, ocasionando daños graves e incluso la muerte del organismo.
- Alberts, B., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2004). Essential cell biology. New York: Garland Science. 2th Edition.
- Cooper, G. M., Hausman, R. E. & Wright, N. (2010). La célula. (pp. 397-402). Ed. Marbán.
- Devlin, T. M. (1992). Textbook of biochemistry: with clinical correlations. John Wiley & Sons, Inc.
- Garrett, R. H., & Grisham, C. M. (2008). Biochemistry. Ed. Thomson Brooks/Cole.
- Rawn, J. D. (1989). Bioquímica (No. 577.1 RAW). Ed. Interamericana-McGraw-Hill
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
