Sulfato de aluminio: qué es, estructura, usos, producción, tipos, toxicidad

¿Qué es el sulfato de aluminio?
El sulfato de aluminio es una sal inorgánica de aluminio de fórmula Al2(SO4)3, que suele presentarse como un sólido blanco de cristales lustrosos. El color del compuesto va a estar influenciado por su concentración de hierro y de cualquier otra impureza. Existen dos tipos principales de sulfato de aluminio: el A y el B.
Es una sal muy soluble en agua, y en la naturaleza es raro encontrarlo en su forma anhidra. Usualmente se encuentra hidratado bajo la forma de sulfato de aluminio octadecahidratado [Al2(SO4)3.18H2O] o hexadecahidratado [Al2(SO4)3.16H2O].
Asimismo, puede formar sales dobles con el potasio, y con el amonio, compuestos conocidos como alumbres. En parte esto puede deberse a la afinidad del agua dentro de los hidratos para retener otros iones, además del aluminio.
Estructura química del sulfato de aluminio
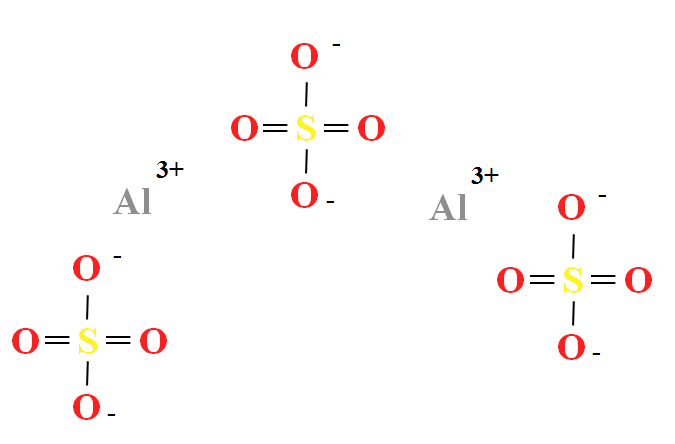
El sulfato de aluminio tiene una proporción de dos cationes Al3+ por cada tres aniones SO42- (imagen superior), lo cual puede observarse directamente en su fórmula química Al2(SO4)3.
Nótese que los Al3+ son de color grisáceo, mientras que los SO42- son amarillos (por el átomo de azufre) y rojos (por los átomos de oxígeno).
La estructura ilustrada corresponde a la forma anhidra del Al2(SO4)3, ya que ninguna molécula de agua interactúa con los iones. En sus hidratos, sin embargo, el agua puede atraerse por los centros positivos de Al3+, o por los tetraedros negativos de SO42- mediante puentes de hidrógeno (HOH— O-SO32-).
El Al2(SO4)3∙18H2O, por ejemplo, contiene 18 moléculas de agua en su estructura sólida. Algunas de ellas pueden estar en contacto directo con el Al3+ o con los SO42-. En otras palabras: el sulfato de aluminio puede tener agua de coordinación interna o externa.
Asimismo, su estructura puede albergar otros cationes como el Fe3+, Na+, K+, etc. Pero para ello, es necesaria la presencia de más aniones SO42-, para neutralizar el incremento de las cargas positivas debido a las impurezas metálicas.
El sulfato de aluminio puede tener muchas estructuras, aunque sus hidratos tienden a adoptar el sistema cristalino monoclínico.
Propiedades físicas y químicas
Aspecto
Se presenta como un sólido con cristales blancos lustrosos, gránulos o polvo.
Peso molecular
342,31 g/mol (anhidro).
Olor
Es inodoro.
Sabor
Sabor dulce, medianamente astringente.
Punto de fusión
770º C forma anhidra (86,5º C forma octadecahidratada).
Solubilidad en agua
31,2 g/100 ml a 0º C; 36,4 g/100 ml a 20º C y 89 g/100 ml a 100º C.
Densidad
2,67 a 2,71 g/cm3.
Solubilidad
Ligeramente soluble en alcohol etílico.
Presión de vapor
Esencialmente cero.
Estabilidad
Estable en el aire.
Descomposición
Cuando se calienta, aproximadamente a su punto de fusión, puede descomponerse emitiendo especialmente óxido de azufre, un gas tóxico.
Corrosividad
Las soluciones de sulfato de aluminio son corrosivas para el aluminio. Asimismo, el compuesto puede corroer metales en presencia de humedad.
pKa
3,3 a 3,6. Y su pH es de 2,9 o más en una solución acuosa al 5%.
Usos del sulfato de aluminio
Coagulación o floculación del agua
- Al mezclarse con el agua (potable, servida o de desecho), el sulfato de aluminio origina hidróxido de aluminio, el cual forma complejos con los compuestos y las partículas en solución acelerando su sedimentación, lo cual en ausencia del tratamiento con sulfato de aluminio tardaría mucho tiempo.
- El sulfato de aluminio también es usado en la limpieza del agua de las piscinas, haciéndolas más atractivas para su uso.
- Mediante el uso del sulfato de aluminio se logra un agua carente de turbidez y color, aumentando su potabilidad al facilitar la limpieza del agua. Lamentablemente este método de purificación puede conducir a una concentración ligeramente aumentada de aluminio en el agua.
- El aluminio es un metal muy tóxico que se acumula en la piel, el cerebro y los pulmones, causando serios trastornos. Además, no se conoce qué función cumple en los seres vivos.
- La Unión Europea exige que el límite máximo permitido del aluminio en el agua no exceda del 0,2 mg/l. Por su parte, el US Enviromental Protection Agency exige que el límite máximo de contaminación del agua con aluminio no exceda al 0,05-0,2 mg/l.
- El tratamiento de las aguas usadas o servidas con sulfato de aluminio permite la eliminación o la reducción del fósforo en ellas, de forma económica.
Uso como mordiente de tintas y en la elaboración del papel
- El sulfato de aluminio ha sido utilizado como mordiente de los colorantes o tintas, ayudando a fijarse sobre el material textil. Su acción fijadora se debe al Al(OH)3, cuya consistencia gelatinosa colabora con la adsorción de los colorantes sobre los textiles.
- Aunque ha sido usado desde aproximadamente el año 2000 a.C. con el fin descrito, solamente los colorantes orgánicos requieren de mordientes. Los colorantes sintéticos, por otro lado, no requieren de mordientes para cumplir su función.
- Ha sido desplazado de la manufactura del papel, pero aún se sigue utilizando en la elaboración de la pulpa de papel. Remueve sus impurezas, así como también se ha empleado para enlazar materiales, neutralizar las cargas y calibrar la colofonia.
Usos industriales
- Se usa en la industria de la construcción con el fin de acelerar el fraguado del concreto. Adicionalmente, se usa en la impermeabilización de las construcciones.
- En la industria de los jabones y grasas se emplea en la producción de glicerina.
- En la industria petrolera, para la elaboración de los catalizadores sintéticos que emplean durante su funcionamiento.
- Se utiliza en la industria farmacéutica como astringente en la preparación de drogas y cosméticos.
- Interviene en la elaboración de colorantes como el carmín. Asimismo, se usa como colorante en la manufactura de cauchos sintéticos de butadieno estireno.
- En la industria de la fabricación del azúcar se utiliza como purificador de la melaza de la caña de azúcar.
- Es usado en fabricación de los desodorantes, pues provoca un estrechamiento de los conductos de las glándulas sudoríperas, limitando así la acumulación del sudor, medio necesario para el crecimiento de las bacterias causantes del mal olor.
- Se utiliza en el curtido del cuero, proceso necesario para su uso. Adicionalmente, se emplea en la fabricación de fertilizantes.
- Se usa como aditivo en la elaboración de las pinturas, los adhesivos y los selladores, así como de productos de limpieza y del cuidado de los mobiliarios.
Usos medicinales y terapéuticos
- El sulfato de aluminio es un adyuvante inmunológico. Por lo tanto, cumple con la función de procesar los antígenos de manera tal que al ser liberados en su sitio de acción, produzcan una mayor producción de anticuerpos para los antígenos que fueron inoculados.
- El adyuvante de Freund y el BCG, así como los otros adyuvantes, incluyendo los endógenos como las interleucinas, son inespecíficos para los antígenos, permitiendo un incremento del radio de la acción inmune. Esto ha permitido la elaboración de las vacunas contras numerosas enfermedades.
- La acción coagulante del sulfato de aluminio ha permitido la eliminación de numerosos virus en el agua tratada, como el Q beta, el MS2, el T4 y el P1, entre otros. Los resultados señalan que el tratamiento del agua con sulfato de aluminio produce una inactivación de tales virus.
- El sulfato de aluminio es usado en forma de barra o como polvo en el tratamiento de pequeñas heridas superficiales o abrasiones producidas al afeitarse.
- Se emplea en la fabricación del acetato de aluminio, compuesto utilizado en el tratamiento de algunas afecciones del oído. También se ha usado, sin éxito significativo, para aliviar las consecuencias de las picaduras de las hormigas de fuego.
- Se utilizan soluciones de sulfato de aluminio, a una concentración del 5% al 10%, en el tratamiento local de úlceras que permitan el control de sus secreciones.
- La acción astringente del sulfato de aluminio contrae las capas superficiales de la piel, coagulando las proteínas y cicatrizando las heridas.
Otros usos
- El sulfato de aluminio ayuda en el control del crecimiento excesivo de algas en los estanques, los lagos y en las corrientes de agua. También se utiliza en la eliminación de moluscos, entre ellos, la babosa española.
- Los jardineros aplican este compuesto para acidificar los suelos alcalinos. En contacto con el agua de los mismos el sulfato de aluminio se descompone en hidróxido de aluminio y ácido sulfúrico diluido. Luego, el hidróxido de aluminio precipita, quedando en solución el ácido sulfúrico.
- La acidificación de los suelos debida al ácido sulfúrico se visualiza de una forma muy creativa, debido a la existencia de una planta llamada Hydrangea, cuyas flores se tornan azules en presencia de un suelo ácido; es decir, son sensibles y responden a los cambios de pH.
- El sulfato de aluminio interviene en la elaboración de una espuma para combatir y controlar el fuego: reacciona con el bicarbonato de sodio, produciendo la liberación de CO2. Este gas bloquea el acceso del O2 al sitio de combustión del material, y en consecuencia el cese del fuego que se estaba desarrollando.
Producción del sulfato de aluminio
El sulfato de aluminio se sintetiza haciendo reaccionar un compuesto rico en aluminio, como el mineral bauxita, con ácido sulfúrico a temperaturas elevadas. La siguiente ecuación química representa la reacción:
Al2O3 + H2SO4 ———> Al2(SO4)3 + 3 H2O
También puede formarse sulfato de aluminio mediante una reacción de neutralización entre el hidróxido de aluminio y el ácido sulfúrico, según la reacción siguiente:
2 Al(OH)3 + 3 H2SO4 + 12 H2O ———> Al2(SO4)3.18H2O
El ácido sulfúrico reacciona con el aluminio para formar el sulfato de amonio y la liberación de moléculas de hidrógeno en forma de gas. La reacción se esquematiza de la forma siguiente:
2 Al + 3 H2SO4 ———–> Al2(SO4)3 + 3 H2
Tipos de sulfato de aluminio
El sulfato de aluminio se clasifica en dos tipos: el tipo A y el tipo B. En el sulfato de aluminio tipo A, los sólidos son de color blanco y tienen una concentración de hierro menor al 0,5%.
En el sulfato de aluminio tipo B, los sólidos son de color marrón y tienen una concentración de hierro menor al 1,5%.
Hay industrias productoras de sulfato de aluminio que tienen criterios distintos para su clasificación. Así, una industria reporta para su preparación de sulfato de aluminio tipo A una concentración máxima del 0,1% de hierro como óxido férrico.
Mientras que para el tipo B señalan una concentración máxima de hierro del 0,35%.
Toxicidad del sulfato de aluminio
- El sulfato de aluminio es un compuesto que ejerce su acción tóxica mediante el contacto con su polvo, provocando así irritación en la piel, y en los casos en que el contacto sea frecuente, una dermatitis.
- En los ojos provoca una fuerte irritación, llegando incluso a producir lesiones permanentes.
- Su inhalación produce irritación de la nariz y la garganta, que puede provocar tos y carraspera.
- Su ingesta provoca irritación gástrica, náuseas y vómitos.
- Hay efectos tóxicos que si bien no son debidos directamente al sulfato de aluminio, lo son indirectamente por su uso. Este es el caso de ciertos efectos tóxicos del aluminio, causados por el uso del sulfato de aluminio en la purificación del agua.
- Los pacientes que son dializados crónicamente usando sales preparadas en el agua purificada mediante el uso del sulfato de aluminio, experimentan trastornos de salud muy severos. Entre dichos trastornos mencionamos anemia, demencia por diálisis y un incremento en las enfermedades óseas.
Referencias
- Wikipedia. (2018). Aluminium sulfate. Tomado de: en.wikipedia.org
- Aris Industrial. Sulfato de aluminio de solución tipo A y B. Tomado de: aris.com.pe
- Christopher Boyd. (09 de junio de 2014). Top Industrial Uses for Aluminum Sulfate. Tomado de: chemservice.com
- PubChem. (2018). Aluminum Sulfate Anhydrous. Tomado de: pubchem.ncbi.nlm.nih.gov
- Andesia Químicos. (20 de agosto de 2009). Hoja de seguridad de sulfato de aluminio. [PDF]. Tomado de: andesia.com
- Chemical Book. (2017). Aluminium Sulfate. Tomado de: chemicalbook.com
