Gangliósidos: estructura, funciones, síntesis y aplicaciones
Los gangliósidos son esfingolípidos de membrana pertenecientes a la clase de los glucoesfingolípidos acídicos. Son de los glucolípidos más abundantes y están involucrados en la regulación de muchas propiedades de membrana, así como de proteínas asociadas con estas. Son especialmente abundantes en los tejidos nerviosos.
Están caracterizados por la presencia de residuos de azúcares con grupos carboxilo (ácidos siálicos) y junto con las sulfatidas, que contienen un grupo sulfato O-ligado en un residuo de glucosa o galactosa. Representan una de las dos familias de glucoesfingolípidos acídicos en los eucariotas.
El término gangliósido fue acuñado en 1939 por el bioquímico alemán Ernst Klenk, cuando hacía referencia a una mezcla de compuestos extraídos del cerebro de un paciente con la enfermedad de Niemann-Pick. No obstante, la primera estructura de un gangliósido fue dilucidada en 1963.
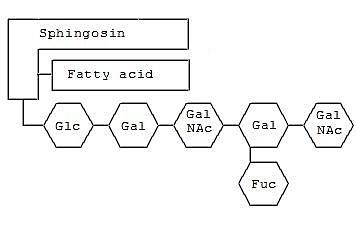
Comparten con los demás esfingolípidos el esqueleto hidrofóbico de ceramida, que está compuesto por una molécula de esfingosina unida por un enlace amida a un ácido graso de entre 16 y 20 átomos de carbono, con un doble enlace en trans entre los carbonos de las posiciones 4 y 5.
Índice del artículo
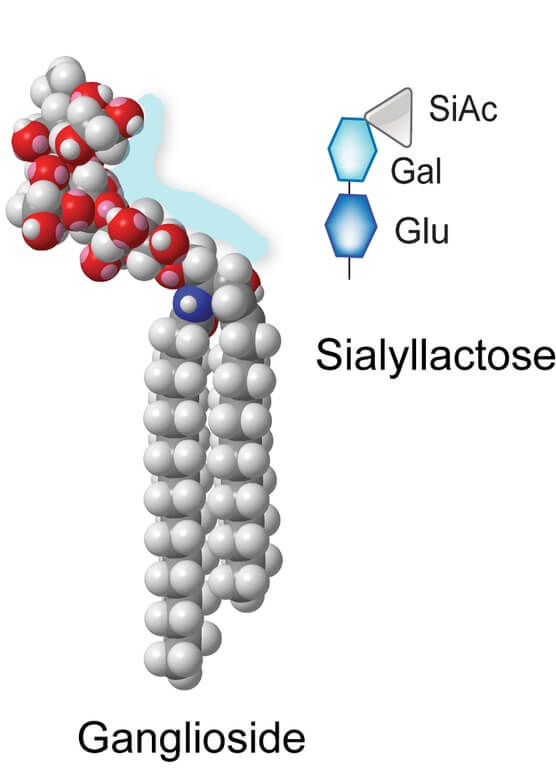
Los gangliósidos están caracterizados por presentar en su grupo de cabeza polar cadenas de oligosacáridos en cuya composición hay moléculas de ácido siálico unidos por enlaces β-glucosídicos al esqueleto hidrofóbico de la ceramida.
Son moléculas extremadamente diversas en vista de las múltiples combinaciones posibles entre las cadenas de oligosacáridos, los diferentes tipos de ácido siálico y las colas apolares unidas al esqueleto de ceramida, tanto de la esfingosina como de los ácidos grasos unidos por enlaces amidas a dicho esqueleto.
En el tejido nervioso las cadenas de ácidos grasos más comunes entre los gangliósidos están representadas por el ácido palmítico y esteárico.
La región de cabeza polar de estos esfingolípidos les proporciona un fuerte carácter hidrofílico. Este grupo polar es muy voluminoso en comparación con el de los fosfolípidos como la fosfatidilcolina, por ejemplo.
La razón de esta voluminosidad tiene que ver con el tamaño de las cadenas de oligosacáridos, así como con la cantidad de moléculas de agua asociadas con estos carbohidratos.
Los ácidos siálicos son derivados del ácido 5-amino-3,5-dideoxi-D-glicero-D-galacto-non-2-ulopiranosoico, o ácido neuramínico. Existen tres tipos de ácidos siálicos conocidos en los gangliósidos: el 5-N-acetil, el 5-N-acetil-9-O-acetil y el 5-N-glicolil-derivativo, que es el más común en humanos sanos.
En general los mamíferos (incluyendo los primates) son capaces de sintetizar el ácido 5-N-glicolil-neuramínico, pero los humanos deben obtenerlo de fuentes alimenticias.
La clasificación de estos lípidos puede basarse tanto en el número de residuos de ácido siálico (de 1-5), como en la posición de los mismos en la molécula del glucoesfingolípido.
La secuencia de oligosacáridos más común es el tetrasacárido Galβ1-3GalNAcβ1-4Galβ1-4Glcβ, pero también pueden hallarse menor número de residuos.
Las implicaciones biológicas exactas de los gangliósidos no han sido completamente dilucidadas, no obstante, parecen estar involucrados en la diferenciación celular y la morfogénesis, en la unión de algunos virus y bacterias, y en procesos de adhesión celular tipo-específico como ligandos para las proteínas selectinas.
Los glucoesfingolípidos con ácido siálico son de especial relevancia en el sistema nervioso, sobre todo en las células de la materia gris del cerebro. Ello tiene que ver con que los glicoconjugados, en general, son reconocidos como eficientes vehículos de información y almacén para las células.
Están ubicados preponderantemente en la monocapa externa de la membrana plasmática, por lo que tienen una participación importante en el glucocálix, junto con glicoproteínas y proteoglicanos.
Este glucocálix o matriz extracelular es esencial para el movimiento celular y la activación de rutas de señalización implicadas en crecimiento, proliferación y expresión genética.
Al igual que lo que sucede con otros esfingolípidos, los subproductos de la degradación de los gangliósidos también tienen funciones importantes, especialmente en procesos de señalización y en el reciclaje de elementos para la formación de nuevas moléculas lipídicas.
Dentro de la bicapa los gangliósidos ocurren en gran medida en las balsas lipídicas ricas en esfingolípidos, donde se establecen “dominios de glico señalización” que también median interacciones intercelulares y señalización transmembrana por estabilización y asociación con proteínas integrales. Estas balsas lipídicas cumplen importantes funciones en el sistema inmunológico.
Promueven la conformación y correcto plegamiento de importantes proteínas de membrana, como es el caso del gangliósido GM1 en el mantenimiento de la estructura helicoidal de la proteína α-sinucleína, cuya forma aberrante está asociada con la enfermedad de Parkinson. También se han asociado con las patologías de la enfermedad de Huntington, Tay-Sachs y Alzheimer.
La biosíntesis de los glucoesfingolípidos depende en gran medida del transporte intracelular a través del flujo de vesículas desde el retículo endoplasmático (ER), pasando por el aparato de Golgi y finalizando en la membrana plasmática.
El proceso biosintético comienza con la formación del esqueleto de ceramida en la cara citoplasmática del ER. La formación de los glucoesfingolípidos ocurre posteriormente en el aparato de Golgi.
Las enzimas glicosidasas encargadas de este proceso (glucosiltransferasa y galactosiltransferasa) se encuentran en la cara citosólica del complejo de Golgi.
La adición de los residuos de ácido siálico a la cadena oligosacárida en crecimiento es catalizada por unas pocas glicosiltransferasas unidas a la membrana, pero que están restringidas al lado luminal de la membrana del Golgi.
Diferentes líneas de evidencia sugieren que la síntesis de los gangliósidos más simples ocurre en la región temprana del sistema de membranas del Golgi, mientras que los más complejos se producen en las regiones más “tardías”.
La síntesis está regulada en primera instancia por la expresión de las glicosiltransferasas, pero también pueden estar involucrados eventos epigenéticos como la fosforilación de las enzimas implicadas y otros.
Algunos investigadores han enfocado su atención en la utilidad de un gangliósido en particular, el GM1. La toxina sintetizada por V. cholera en los pacientes coléricos posee una subunidad encargada del reconocimiento específico de este gangliósido, que es presentado en la superficie de las células mucosas del intestino.
Así pues, el GM1 ha sido empleado para el reconocimiento de marcadores de esta patología al ser incluido en la síntesis de liposomas utilizados para el diagnóstico de cólera.
Otras aplicaciones incluyen la síntesis de gangliósidos específicos y su unión a soportes estables con fines de diagnóstico o para la purificación y aislamiento de compuestos para los que estos tengan afinidad. También se ha determinado que pueden servir de marcadores para algunos tipos de cáncer.
- Groux-Degroote, S., Guérardel, Y., Julien, S., & Deannoy, P. (2015). Gangliosides in Breast Cancer : New Perspectives. Biochemistry (Moscow), 80(7), 808–819.
- Ho, J. A., Wu, L., Huang, M., Lin, Y., Baeumner, A. J., Durst, R. A., & York, N. (2007). Application of Ganglioside-Sensitized Liposomes in a Flow Injection Immunoanalytical System for the Determination of Cholera Toxin. Anal. Chem., 79(1), 10795–10799.
- Kanfer, J., & Hakomori, S. (1983). Sphingolipid Biochemistry. (D. Hanahan, Ed.), Handbook of Lipid Research 3 (1st ed.). Plenum Press.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Molecular Cell Biology (5th ed.). Freeman, W. H. & Company.
- O’Brien, J. (1981). Ganglioside storage diseases : an updated review. Ital. J. Neurol. Sci., 3, 219–226.
- Sonnino, S. (2018). Gangliosides. In S. Sonnino & A. Prinetti (Eds.), Methods in Molecular Biology 1804. Humana Press.
- Tayot, J.-L. (1983). 244,312. United States.
- van Echten, G., & Sandhoff, K. (1993). Ganglioside Metabolism. The Journal of Biological Chemistry, 268(8), 5341–5344.
