Potenciómetro (pHmetro): qué es, para qué sirve, cómo funciona

¿Qué es un potenciómetro?
Un potenciómetro es el dispositivo que se utiliza para medir la diferencia de potencial existente entre un electrodo de trabajo y uno de referencia, cuando ambos están sumergidos en una solución de la cual se desea determinar su acidez o basicidad, expresando esta como pH.
De esta manera, la potenciometría se refiere al método analítico empleado en la determinación de la concentración de iones H+ en una sustancia que se encuentra en solución, mediante el uso de un potenciómetro y los dos electrodos antes mencionados.
En el caso del electrodo de referencia, este posee un potencial conocido, constante y estable a diferencia del electrodo de trabajo. El potencial que se desarrolla en este último electrodo varía en proporción a la concentración de iones H+ que se encuentren en la solución.
Este potencial también es influenciado enormemente por la temperatura a la que se lleve a cabo la medición.
¿Para qué sirve un potenciómetro?
Existe una gran cantidad de procesos que se llevan a cabo en el ámbito industrial —como la producción de fármacos, el procesamiento de alimentos y la purificación de agua— que son altamente sensibles a la variación en los niveles de pH. Por esta razón es tan importante su correcta medición.
Como se mencionó previamente, el pH es un parámetro utilizado para medir la acidez o alcalinidad de una solución que se encuentra en fase acuosa mediante el análisis de la concentración de iones H+ en la solución. Luego, el valor del pH es calculado mediante la siguiente ecuación:
pH = -log [H+]
De manera que el potenciómetro se emplea en la medición del pH de una sustancia en solución.
Cuando se conecta el potenciómetro a los dos electrodos inmersos en la solución que desea analizarse, este detecta la diferencia de potencial entre el electrodo de trabajo y el de referencia, amplificando esta señal y convirtiéndola en un valor de pH utilizando la ecuación antes descrita.
¿Cómo funciona un potenciómetro?
El funcionamiento de un potenciómetro se basa en el mecanismo de una celda electroquímica, donde se involucran iones H+ en la reacción química de la celda para determinar la concentración de estos iones en la solución y, de esta manera, obtener el pH de la misma.
Cuando se desea medir el pH de una solución mediante la potenciometría se emplea un potenciómetro y un electrodo; el primero es el dispositivo que determina el pH, mientras que el segundo se basa en la combinación de un electrodo de referencia y otro de medición que es sensible a los analitos.
En este sentido, se forma un circuito por donde fluye la corriente eléctrica entre los electrodos y la solución, donde estos ejercen la función de una batería cuando se sumergen en la mencionada solución.
De esta manera, el potenciómetro está diseñado con el fin de generar un voltaje igual a cero (en unidades de milivoltios) cuando se tiene un pH igual a siete; es decir, neutro.
Asimismo, cuando se registra un incremento en los valores de potencial (con números positivos) significa que se tienen valores menores de pH, y cuando se observa una disminución de estos —es decir, un crecimiento hacia los números negativos— se habla de valores mayores de pH.
Electrodos
El electrodo de medición (o de trabajo) consiste en un dispositivo donde se lleva a cabo la reacción que se está estudiando (oxidación o reducción).
Aunque existen muchos tipos generalmente es de vidrio, constituido por una membrana muy fina de vidrio que posee permeabilidad ante los iones H+ del medio en el que está.
Al colocar este en una solución que posea un pH distinto al de la solución presente en la celda, se genera una diferencia de potencial entre las dos caras de la membrana y esta diferencia puede ser registrada por medio de un electrodo de referencia.
Por otro lado, el electrodo de referencia es un dispositivo que posee características de potencial estable y con valor conocido, el cual se emplea normalmente como el ánodo en la celda electroquímica.
Un ejemplo de este tipo de electrodo es aquel que se compone de un cable de plata, el cual está revestido con cloruro de plata e inmerso en una solución de ácido clorhídrico diluido, o el electrodo de referencia saturado de calomelano, como el que se muestra en la figura a continuación.
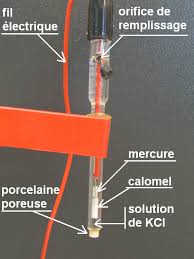
De manera que el potenciómetro determina la diferencia de potencial que se genera entre los electrodos, aunque solo el potencial del electrodo de trabajo depende de las concentraciones de las especies iónicas.
Calibración de un potenciómetro
La calibración de un potenciómetro se debe realizar a través soluciones amortiguadoras (también llamadas buffer o soluciones tampón) conocidas, las cuales consisten en sistemas con pH prácticamente invariable que contienen una sustancia de carácter débil y su especie conjugada.
Cada solución amortiguadora posee un pH específico, el cual puede ser ácido (pH7), básico (pH>7) o neutro (pH=7), y pueden adquirirse de manera comercial ya estandarizadas o prepararse en el laboratorio con reactivos certificados y mediante el uso de procedimientos establecidos y validados.
Como los potenciómetros miden el valor del pH dentro de un rango que se considera amplio, debe conocerse si el analito posee un pH mayor o menor a siete para proceder a su correcta calibración.
De manera que, para muestras cuyo pH se espera que sea básico se debe calibrar con una solución amortiguadora de pH igual a siete y otra de pH mayor (normalmente se utiliza una de pH diez).
En cambio, para muestras con un pH esperado de tipo ácido se calibra con una solución amortiguadora de pH igual a siete y otra de pH menor (normalmente se utiliza una de pH cuatro).
Finalmente, debe realizarse la recalibración de este instrumento de medición antes y después de cada uso, registrando sus resultados, incluyendo la fecha y hora en la que fueron realizadas y las características de las soluciones amortiguadoras empleadas para tener un control del mismo.
