SGLT (Proteínas de transporte sodio-glucosa)
Las proteínas de transporte sodio-glucosa(SGLT) son las encargadas de realizar el transporte activo de glucosa en las células de mamífero en contra de un gradiente de concentración. La energía requerida para hacer posible este transporte la adquieren del cotransporte de sodio en la misma dirección (simporte).
Su localización se limita a la membrana de las células que forman los tejidos epiteliales encargados de la absorción y reabsorción de nutrientes (intestino delgado y el túbulo contorneado proximal del riñón).
Hasta la fecha, han sido descritas solo seis isoformas pertenecientes a esta familia de transportadores: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 y SGLT-6. En todas ellas, la corriente electroquímica generada por el transporte del ión sodio proporciona energía e induce el cambio conformacional en la estructura de la proteína necesario para traslocar el metabolito al otro lado de la membrana.
Sin embargo, todas estas isoformas se diferencian entre sí por presentar diferencias en:
- El grado de afinidad que tienen por la glucosa,
- La capacidad para llevar a cabo el transporte de glucosa, galactosa y aminoácidos,
- El grado en el que son inhibidas por florizina y
- La Localización tisular.
Índice del artículo
- 1 Mecanismos moleculares del transporte de Glucosa
- 2 Características de las SGLT
- 3 Tipos de SGLT
- 4 Estructura de los GSLT
- 5 Funciones de los SGLT
- 6 Referencias
La glucosa es un monosacárido de seis átomos de carbono que es empleado por la mayoría de los tipos celulares existentes para obtener energía a través de vías metabólicas de oxidación.
Dado su gran tamaño y su naturaleza esencialmente hidrofilíca, es incapaz de atravesar las membranas celulares por libre difusión. Por tanto, su movilización al citosol depende de la presencia de proteínas de transporte en dichas membranas.
Los transportadores de glucosa hasta ahora estudiados realizan el transporte de este metabolito por mecanismos de transporte pasivos o activos. El transporte pasivo se diferencia del transporte activo en que no requiere de un suministro energético para ser llevado a cabo, puesto que ocurre a favor de un gradiente de concentración.
Las proteínas involucradas en el transporte pasivo de glucosa pertenecen a la familia de transportadores de difusión facilitada GLUTs, denominada así por las siglas en inglés del término “Glucose Transporters”. Mientras que aquellas que llevan a cabo un transporte activo de la misma han sido denominadas SGLT por “proteínas de transporte sodio-glucosa”.
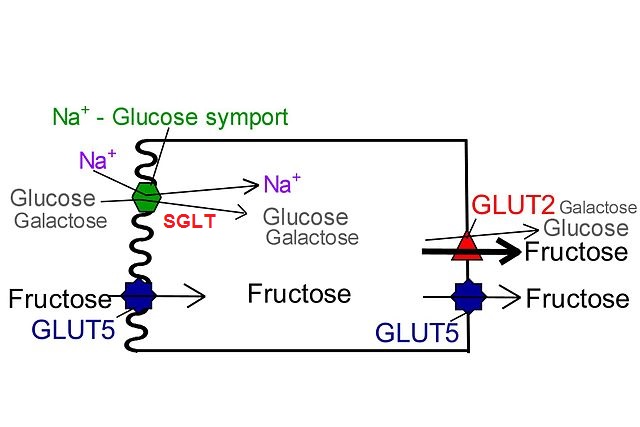
Estas últimas obtienen la energía libre necesaria para llevar a cabo el transporte de glucosa en contra de su gradiente de concentración del cotransporte del ión sodio. Al menos 6 isoformas de SGLT han sido identificadas y su localización parece restringirse a las membranas de células epiteliales.
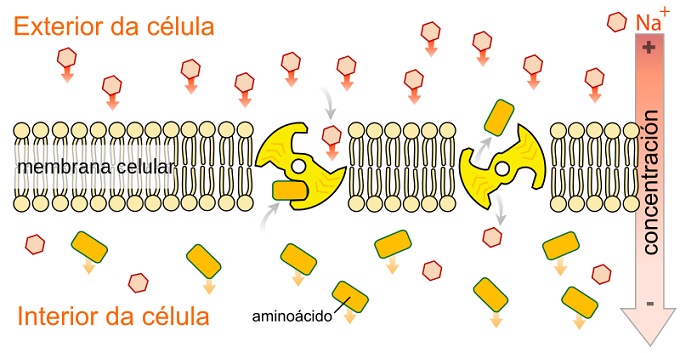
Tal y como lo indica su nombre, las proteínas de transporte sodio-glucosa realizan el cotransporte de tipo simporte de sodio y glucosa o sodio y galactosa al citosol celular.
El transporte de sodio a favor de un gradiente de concentración es el responsable de generar la energía libre indispensable para poder movilizar la glucosa desde una zona de baja concentración a una de alta concentración.
Estos transportadores forman parte de un grupo de proteínas antiportadoras y simportadoras de sodio e hidrogeno cuyos genes no se encuentran filogenéticamente relacionados.
Su localización se restringe a la membrana luminal de las células epiteliales de tejidos involucrados en la absorción de nutrientes, tales como el intestino delgado y el túbulo contorneado proximal.
Hasta la fecha han sido identificadas seis isoformas de transportadores SGLT (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 y SGLT-6). Todas muestran diferencias en la preferencia de transportar glucosa o galactosa, la afinidad que presentan por estos azúcares y por el sodio y por el hecho de poder ser inhibidas por florizina.
SGLT1 tiene la capacidad de transportar galactosa además de glucosa con una cinética muy parecida, mientras que SGLT2 solo transportan glucosa.
La longitud de la secuencia peptídica de las proteínas SGLT oscila entre los 596 a 681 residuos de aminoácidos. Mientras, los porcentajes de homología entre las secuencias varía entre 50 y 84 % en relación a SGLT-1, encontrándose el mayor grado de divergencia en las secuencias que se corresponden con el dominio extracelular amino terminal y carboxilo terminal.
La estructura general coincide con la de una proteína integral multipaso, es decir, que atraviesa la membrana múltiples veces a través de dominios transmembrana ricos en aminoácidos hidrofóbicos.
Estos dominios transmembrana son 14 en total y cada uno de ellos presenta una estructura secundaria α-hélice. Los segmentos 1, 2, 5, 7 y 9 se encuentran organizados espacialmente en una posición central dando lugar a la formación del poro hidrofílico.
A través del poro hidrofílico transita la glucosa, así como cualquiera de los otros metabolitos para los que el transportador pueda tener afinidad. Los fragmentos helicoidales restantes se organizan paralelamente para conferirle mayor estabilidad estructural al canal.
Los miembros de la familia SGLT no muestran especificidad única para la glucosa. Por el contrario, son capaces de movilizar activamente a través de la membrana de las células del túbulo renal y del epitelio intestinal una gran variedad de metabolitos tales como aminoácidos, iones, glucosa y osmolitos.
La función de este tipo de transportadores que ha sido más ampliamente estudiada es la reabsorción de la glucosa presente en la orina.
Este proceso de reabsorción involucra la movilización del carbohidrato desde los túbulos renales a través de las células del epitelio tubular hasta el lumen de los capilares peritubulares. Siendo la isoforma de alta capacidad y afinidad por la glucosa SGLT-2, la cual es la principal contribuyente.
La función de absorción de glucosa en el tracto intestinal es atribuida a SGLT-1, un transportador que a pesar de tener baja capacidad tiene una elevada afinidad por la glucosa.
El tercer miembro de esta familia, SGLT3, es expresado en las membranas de las células del músculo esquelético y del sistema nervioso, donde parece no actuar como un transportador de glucosa sino como sensor de las concentraciones de este azúcar en el medio extracelular.
Las funciones de las isoformas SGLT4, SGLT5 y SGLT6 no han sido hasta ahora determinadas.
- Abramson J, Wright EM. Structure and function of Na symporters with inverted repeats. Curr Opin Struct Biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Studies on the mechanism of intestinal absorption of sugars. VII. Phenylglycoside transport and its possible relationship to phlorizin inhibition of the active transport of sugars by the small intestine. Biochim Biophys Acta. 1964; 93:116-135.
- Charron FM, Blanchard MG, Lapointe JY. Intracellular hypertonicity is responsible for water flux associated with Na_/glucose cotransport. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Fast voltage clamp discloses a new component of presteady-state currents from the Na_-glucose cotransporter. Biophys J. 1996; 71:2544-2552.
- Dyer J, Wood IS, Palejwala A, Ellis A, Shirazi-Beechey SP. Expression of monosaccharide transporters in intestine of diabetic humans. Am J Physiol Gastrointest Liver Physiol. 2002; 282: G241-G248.
- Soták M, Marks J, Unwin RJ. Putative tissue location and function of the SLC5 family member SGLT3. Exp Physiol. 2017; 102(1):5-13.
- Turk E, Wright EM. Membrane topology motifs in the SGLT cotransporter family. J Membr Biol. 1997; 159: 1-20.
- Turk E, Kim O, le Coutre J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Molecular characterization of Vibrio parahaemolyticus vSGLT: a model for sodium-coupled sugar cotransporters. J Biol Chem. 2000; 275: 25711–25716.
- Taroni C, Jones S, Thornton JM. Analysis and prediction of carbohydrate binding sites. Protein Eng. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama BA. Biology of human sodium glucose transporters. Physiol Rev. 2011; 91(2):733-794.
