Reacción exotérmica: concepto, características y ejemplos
¿Qué son las reacciones exotérmicas?
Las reacciones exotérmicas son reacciones químicas que liberan energía en forma de calor. La palabra exotérmica está formada por “exo” que significa “hacia afuera”, y “termos” que significa calor, así que “reacción exotérmica” significa literalmente, reacción en la que el calor va hacia afuera.
Estas reacciones son muy comunes y las podemos encontrar en todas partes, desde nuestros hogares hasta en las células que forman parte de nuestro cuerpo.
En el hogar las podemos encontrar en la cocina cuando se quema el gas en la hornilla para cocinar nuestros alimentos. También las encontramos en el interior de los motores de los automóviles cuando estos queman el combustible.

Por otro lado, las reacciones exotérmicas son esenciales para la vida, ya que les proporcionan a las células la energía que requieren para vivir, crecer y reproducirse.
Características de las reacciones exotérmicas
Liberan energía en forma de calor
Esta es la característica principal que las hace ser reacciones exotérmicas.
La energía liberada proviene de los mismos reactivos
Toda reacción química requiere de cierta energía de activación para ocurrir. En el caso de las reacciones exotérmicas, esta energía viene de los mismos reactivos cuando se transforman en productos.
Los productos de las reacciones exotérmicas siempre son más estables que los reactivos.
Los reactivos al convertirse en productos, pierden parte de su energía en forma de calor. Por esta razón, los productos siempre quedan con menos energía que los reactivos, lo que los hace más estables.
Tienen una variación de entalpía (AH) negativa.
Esta es una forma fácil de saber si una reacción es exotérmica o no. Cualquier reacción que tenga un AH (se lee delta H) negativo, será exotérmica.
- Por ejemplo, la reacción de combustión del butano (el gas que quemamos en la cocina) tiene una variación de entalpía de -11.823 kcal/mol. Por lo tanto, es una reacción exotérmica.
Solo necesitan un detonante para ocurrir en la mayoría de los casos.
Muchas reacciones exotérmicas solo necesitan algo que les dé la energía suficiente para iniciar. Luego de esto, el mismo calor que ellas liberan es suficiente para mantener a la reacción andando.
- Por ejemplo, al quemar gas, solo hace falta una chispa, luego la llama continúa encendida hasta que se acabe el gas.
Diferencias entre reacciones exotérmicas y reacciones endotérmicas
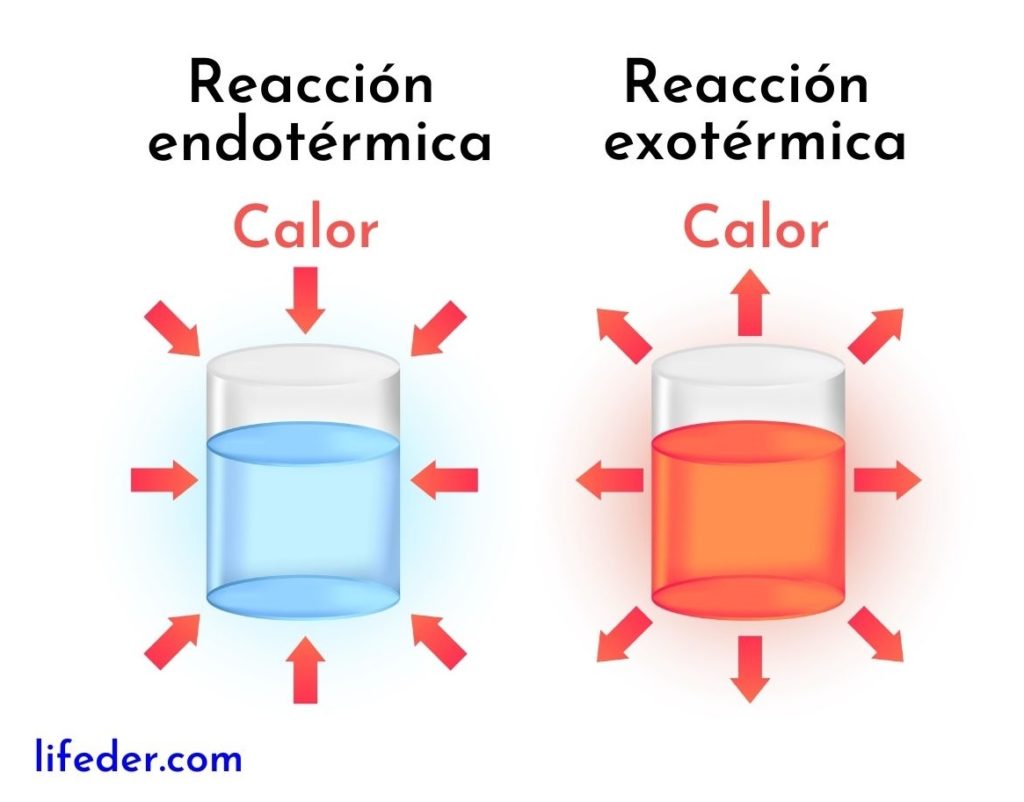
Las reacciones exotérmicas son lo contrario de las reacciones endotérmicas. En estas últimas, los reactivos absorben energía en forma de calor en lugar de liberarla, como ocurre en las reacciones exotérmicas.
A continuación, se presentan las diferencias principales entre las reacciones exotérmica y las endotérmicas:
Reacciones exotérmicas | Reacciones endotérmicas |
Liberan energía en forma de calor. | Absorben energía en forma de calor. |
Tienen una variación de entalpía negativa, es decir DH0. | Tienen una variación de entalpía positiva, es decir DH>0. |
Tienden a aumentar la temperatura de los alrededores. | Tienden a disminuir la temperatura o enfriar a los alrededores. |
La energía que mantiene a la reacción andando proviene de los mismos reactivos. | La energía que mantiene a la reacción andando proviene de los alrededores. |
Siempre se obtienen productos más estables y con menor energía. | Siempre se obtienen productos menos estables con un nivel mayor de energía. |
Ejemplos de reacciones exotérmicas
La combustión del gas de cocina
En la mayor parte de los hogares del mundo, el gas que se utiliza para cocinar los alimentos es butano, que tiene la fórmula molecular C4H10. Este hidrocarburo se quema con el oxígeno del aire por medio de la siguiente reacción de combustión liberando grandes cantidades de calor:
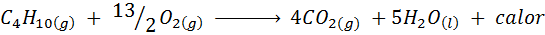
La explosión de la dinamita
La dinamita contiene un explosivo denominado nitroglicerina (C3H5N3O9). Este compuesto se descompone muy violentamente liberando grandes cantidades de calor, lo que causa una gran explosión. La reacción química es:
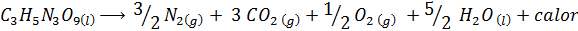
Esta reacción tiene un ΔH=-368 kcal⁄mol, por lo que es una reacción exotérmica.
La combustión espontánea del fósforo blanco
El elemento fósforo (P) se puede encontrar como fósforo rojo o fósforo blanco. El fósforo blanco se quema espontáneamente al entrar en contacto con el aire por lo que se utiliza como mecha para las granadas de mano. La reacción es:
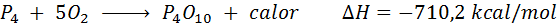
La respiración celular
La respiración celular es una reacción química exotérmica que consiste en la oxidación de los alimentos que ingerimos. El calor liberado por esta reacción es aprovechado por las células para llevar a cabo un sinfín de reacciones químicas endotérmicas que requieren energía para ocurrir.
Los fuegos artificiales
Los fuegos artificiales contienen pólvora negra como principal componente explosivo. La pólvora es una mezcla que contiene nitrato de potasio, carbono grafito y azufre que reaccionan entre sí por medio de una reacción exotérmica. El calor que esta reacción libera, genera la amplia gama de colores que vemos en el cielo cuando los fuegos artificiales explotan.
La almohadilla térmica química
Las almohadillas térmicas se utilizan como compresas calientes para aliviar lesiones deportivas. Estas consisten en una bolsa sellada que contiene agua y un químico dentro de un pequeño tubo. Al romperse el tubo, el químico se mezcla con el agua produciendo una reacción química exotérmica que calienta la almohadilla.
Reacción del sodio metálico con agua
El sodio (Na) es un metal alcalino muy reactivo que al entrar en contacto con el agua reacciona violentamente liberando mucho calor e hidrógeno gaseoso. La reacción es:
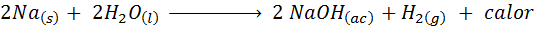
Esta reacción libera 1900 calorías por cada gramo de Na que reacciona con agua. Esto quiere decir que 1 gramo de sodio sería suficiente para calentar 3 tazas medianas de café.
Disolución de detergente
Esta es una reacción que cualquiera puede experimentar en su hogar. Al tomar un puñado de detergente en polvo para lavar ropa con la mano y mojarlo con un poco de agua, la mano inmediatamente se sentirá caliente. Esto se debe a que el proceso de disolución del detergente en agua es exotérmico.
La reacción de la termita
La termita es una mezcla de aluminio en forma de un polvo muy fino y un óxido de otro metal como el hierro. Tras una chispa, la reacción que ocurre es:
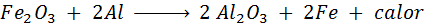
Esta reacción libera tanto calor, que es capaz de derretir al hierro y se utiliza mucho para soldar rieles de trenes.
La condensación del agua
Para todas las sustancias, los cambios de fase de gas a líquido (condensación), de líquido a sólido (solidificación) y de gas a sólido (deposición), siempre liberan calor y por lo tanto son procesos exotérmicos. En el caso del agua, la condensación de apenas 18 gramos de agua libera aproximadamente 10.000 calorías, lo cual es suficiente para calentar 15 tazas pequeñas de café.
Referencias
- Chang, R. and Goldsby, K. (2014). Chemistry. 11th ed. New York: McGraw-Hill Education.
- Exothermic reaction (2020, 19 de Diciembre). En Wikipedia. Tomado de en.wikipedia.org
- Holmes, W. S. (1963). Heat of combustion of phosphorus and the enthalpies of formation of P4O10 and H3PO4. Faraday Soc. 58. 1916-1925. DOI:10.1039/TF9625801916.
- Prada P. de A., F. I. (2014). Petardos, cohetes y mucha química. Educación Química. 44-51. DOI: 10.2436/20.2003.02.134
- Thermite reaction. University of Minnesota (Department of Chemistry). Tomado de chem.umn.edu
