Transmitancia: qué es, diagrama de energía molecular y ejercicio
La transmitancia óptica es el cociente entre la intensidad luminosa emergente y la intensidad luminosa incidente sobre una muestra de solución traslúcida que ha sido iluminada con luz monocromática.
El proceso físico del paso de la luz a través de una muestra se llama transmisión luminosa y la transmitancia es una medida de la transmisión luminosa. La transmitancia es un valor importante para determinar la concentración de una muestra que generalmente está disuelta en un solvente como puede ser agua o alcohol, entre otros.
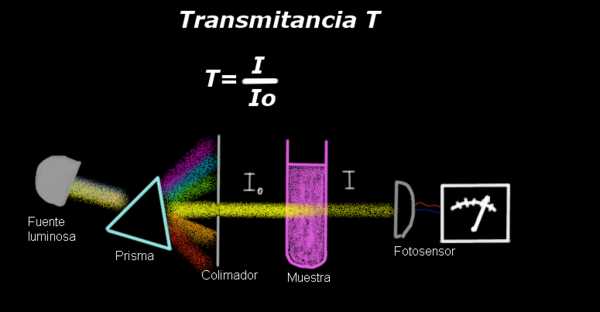
Un electro-fotómetro mide una corriente proporcional a la intensidad luminosa que incide sobre su superficie. Para calcular la transmitancia generalmente se mide primero la señal de la intensidad correspondiente al solvente solo y se registra este resultado como Io.
Luego se coloca la muestra disuelta en el solvente con la mismas condiciones de iluminación y la señal medida por el electro-fotómetro se denota como I, entonces la transmitancia se calcula de acuerdo a la siguiente fórmula:
T = I / Io
Debe notarse que la transmitancia es una cantidad adimensional, debido a que es una medida de la intensidad luminosa de un muestra en relación a la intensidad de transmisión del solvente.
Índice del artículo
Cuando la luz pasa a través de una muestra, parte de la energía luminosa es absorbida por las moléculas. La transmitancia es la medida macroscópica de un fenómeno que ocurre a nivel molecular o atómico.
La luz es una onda electromagnética, la energía que transporta está en el campo eléctrico y magnético de la onda. Estos campos oscilantes interactúan con las moléculas de una sustancia.
La energía que transporta la onda depende de su frecuencia. La luz monocromática tiene una sola frecuencia, mientras que la luz blanca tiene una gama o espectro de frecuencias.
Todas las frecuencias de una onda electromagnética viajan en el vacío a la misma velocidad de 300000 km/s. Si denotamos por c a la velocidad de la luz en el vacío, la relación entre frecuencia f y longitud de onda λ es:
c = λ⋅f
Como c es una constante a cada frecuencia corresponde su respectiva longitud de onda.
Para medir la transmitancia de una sustancia se usan las regiones del espectro electromagnético visible (380 nm a 780 nm), la región ultravioleta (180 a 380 nm) y la del infrarrojo (780 nm hasta 5600 nm)
La velocidad de propagación de la luz en un medio material depende de la frecuencia y es menor que c. Esto explica la dispersión en un prisma con el cual pueden separarse las frecuencias que componen la luz blanca.
Los átomos y las moléculas poseen niveles de energía cuantizados. A la temperatura ambiente las moléculas están en sus niveles de energía más bajos.
El fotón es la partícula cuántica asociada a la onda electromagnética. La energía del fotón también está cuantizada, es decir que un fotón de frecuencia f tiene energía dada por:
E = h⋅f
donde h es la constante de Planck cuyo valor es 6,62×10^-34 J⋅s.
La luz monocromática es un haz de fotones de una frecuencia y una energía dada.
Las moléculas absorben fotones cuando la energía de los mismos coincide con la diferencia necesaria para llevar a la molécula a un nivel energético superior.
Las transiciones de energía por absorción de fotones en las moléculas pueden ser de varios tipos:
1- Transiciones electrónicas, cuando los electrones de los orbitales moleculares pasan a orbitales de mayor energía. Estas transiciones ocurren generalmente en el rango visible y ultravioleta y son las más importantes.
2- Transiciones vibracionales, las energías de enlace molecular también están cuantizadas y cuando se absorbe un fotón de la región infrarroja la molécula pasa a un estado de energía vibracional más alto.
3- Transiciones rotacionales, cuando la absorción de un fotón lleva a la molécula a un estado rotacional de mayor energía.
Estas transiciones se entienden mejor con un diagrama de energías moleculares que se muestra en la figura 2:
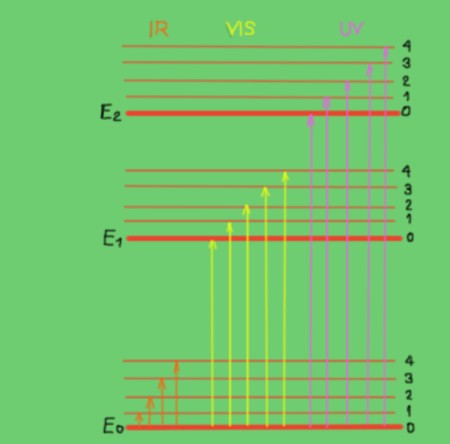
En el diagrama las líneas horizontales representan distintos niveles energéticos moleculares. La línea E0 es nivel fundamental o de menor energía. Los niveles E1 y E2 son niveles excitados de mayor energía. Los niveles E0, E1, E2 corresponden a los estados electrónicos de la molécula.
Los subniveles 1, 2, 3, 4 dentro de cada nivel electrónico corresponden a los distintos estados vibracionales correspondientes a cada nivel electrónico. Cada uno de estos niveles tiene subdivisiones más finas que no se muestran que corresponden a los estados rotacionales asociados a cada nivel vibracional.
El diagrama muestra flechas verticales que representan la energía de los fotones en el rango infrarrojo, visible y ultravioleta. Como puede verse los fotones infrarrojos no tienen energía suficiente para promover transiciones electrónicas, en cambio la radiación visible y la ultravioleta sí.
Cuando los fotones incidentes de un haz monocromático coinciden en energía (o frecuencia) con la diferencia de energía entre estados de energía molecular, entonces se produce la absorción de fotones.
De acuerdo a lo dicho en el apartado anterior, la transmitancia dependerá entonces de varios factores entre los que podemos nombrar:
1- La frecuencia con la que se ilumina la muestra.
2- El tipo de moléculas que se quiere analizar.
3- La concentración de la solución.
4- La longitud del camino recorrido por el haz luminoso.
Los datos experimentales indican que la transmitancia T disminuye exponencialmente con la concentración C y con la longitud L del camino óptico:
T = 10-a⋅C⋅L
En la expresión anterior a es una constante que depende de la frecuencia y el tipo de sustancia.
Una muestra patrón de cierta sustancia tiene una concentración de 150 micromoles por litro (μM). Cuando se mide su transmitancia con luz de 525 nm se obtiene una transmitancia de 0.4.
Otra muestra de la misma sustancia, pero de concentración desconocida tiene una transmitancia de 0.5, cuando se mide a la misma frecuencia y con el mismo espesor óptico.
Calcule la concentración de la segunda muestra.
Respuesta
La transmitancia T decae exponencialmente con la concentración C:
T = 10-b⋅L
Si se el toma logaritmo de la igualdad anterior queda:
log T = -b⋅C
Dividiendo miembro a miembro la igualdad anterior aplicada a cada muestra y despejando la concentración desconocida queda:
C2 = C1⋅(log T2 / log T1)
C2 = 150μM⋅(log 0.5 / log 0.4)= 150μM⋅(-0.3010 / -0.3979)=113.5μM
- Atkins, P. 1999. Química Física. Ediciones Omega. 460-462.
- La guía. Transmitancia y absorbancia. Recuperado de: quimica.laguia2000.com
- Toxicología Ambiental. Transmitancia, absorbancia y ley de Lambert. Recuperado de: repositorio.innovacionumh.es
- Física aventura. Absorbancia y transmitancia. Recuperado de: rpfisica.blogspot.com
- Spectophotometry. Recobrado de:chem.libretexts.org
- Toxicología Ambiental. Transmitancia, absorbancia y ley de Lambert. Recuperado de: repositorio.innovacionumh.es
- Wikipedia. Transmitancia. Recuperado de: wikipedia.com
- Wikipedia. Espectrofotometría. Recuperado de: wikipedia.com
