Nitrato de plata (AgNO3): estructura, propiedades, usos, toxicidad
El nitrato de plata es una sal inorgánica cuya fórmula química es AgNO3. De todas las sales de plata, es la más económica y la que presenta una relativa estabilidad frente a la luz solar, por lo que tiende menos a descomponerse. Es la fuente de plata soluble y predilecta en todo laboratorio de docencia o investigación.
En la docencia, las soluciones acuosas de nitrato de plata se utilizan para enseñar las reacciones de precipitación de cloruro de plata. Asimismo, estas soluciones se ponen en contacto con cobre metálico para que tome lugar una reacción rédox, en la cual precipita la plata metálica en medio de la disolución formada del nitrato de cobre, Cu(NO3)2.

En la imagen superior se muestra un frasco con nitrato de plata. Puede mantenerse expuesto a la luz sin que ocurra un pronto oscurecimiento de sus cristales, producto de la aparición del óxido de plata.
A raíz de las costumbres alquímicas, y de las propiedades antibacterianas de la plata metálica, el nitrato de plata se ha venido utilizando para desinfectar y cauterizar heridas. No obstante, para este fin se usan soluciones acuosas muy diluidas, o su sólido mezclado con nitrato de potasio aplicado mediante la punta de unas varillas de madera.
Índice del artículo
- 1 Estructura del nitrato de plata
- 2 Preparación
- 3 Propiedades físicas y químicas
- 4 Usos del nitrato de plata
- 5 Toxicidad y efectos secundarios
- 6 Referencias
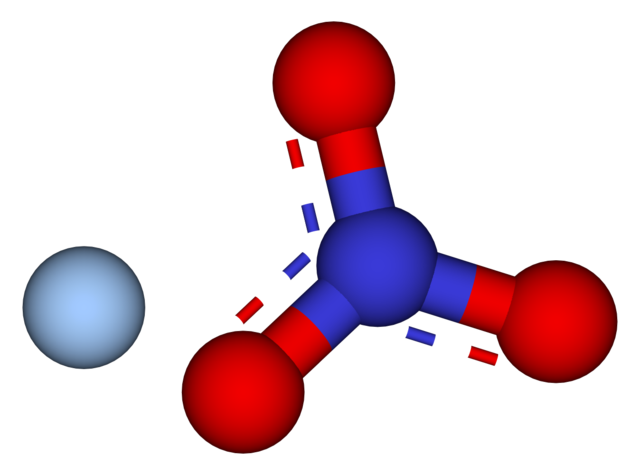
En la imagen superior se muestran los iones Ag+ y NO3– del nitrato de plata, los cuales están representados por un modelo de esferas y barras. La fórmula AgNO3 indica la proporción estequiométrica de esta sal: por cada catión Ag+ hay un anión NO3– interaccionando con él electrostáticamente.
El anión NO3– (de esferas rojas y azulada) tiene geometría plano trigonal, con la carga negativa deslocalizándose entre sus tres átomos de oxígeno. Por lo tanto, las interacciones electrostáticas entre ambos iones tienen lugar específicamente entre el catión Ag+ y un átomo de oxígeno del anión NO3– (Ag+—ONO2–).
De esta manera, cada Ag+ termina coordinándose o rodeándose de tres NO3– adyacentes en un mismo plano o capa cristalográfica. El agrupamiento de estos planos termina definiendo un cristal cuya estructura es ortorrómbica.
El nitrato de plata se prepara atacando una pieza de plata metálica bruñida con ácido nítrico, ya sea diluido en frío, o concentrado en caliente:
3 Ag + 4 HNO3 (diluido) → 3 AgNO3 + 2 H2O + NO
Ag + 2 HNO3 (concentrado) → AgNO3 + H2O + NO2
Nótese la formación de los gases NO y NO2, los cuales son tóxicos, y obligan a que esta reacción no se lleve a cabo fuera de una campana extractora.
Sólido cristalino incoloro, inodoro, pero de sabor muy amargo.
169,872 g/mol
209,7 ºC
440 ºC. Sin embargo, a esta temperatura sufre una descomposición térmica, en la que se produce plata metálica:
2 AgNO3(l) → 2 Ag (s) + O2 (g) + 2 NO2 (g)
No existen pues vapores de AgNO3, al menos no en condiciones terrestres.
El AgNO3 es una sal increíblemente soluble en agua, teniendo una solubilidad de 256 g/ 100 mL a 25 ºC. También es soluble en otros solventes polares como el amoníaco, el ácido acético, la acetona, el éter y el glicerol.
4,35 g/cm3 a 24 ºC (temperatura ambiente)
3,97 g/cm3 a 210 ºC (justo en el punto de fusión)
El AgNO3 es una sustancia estable siempre que esté debidamente almacenada. No se inflamará a ninguna temperatura, aunque puede descomponerse liberando humos tóxicos de óxidos de nitrógeno.
Por otro lado, aunque el nitrato de plata no sea inflamable, es un poderoso agente oxidante que al entrar en contacto con la materia orgánica y una fuente calor es capaz de desencadenar una reacción exotérmica y explosiva.
Además de esto, esta sal tampoco debe exponerse demasiado tiempo a la luz solar, ya que se oscurecen sus cristales debido a la formación del óxido de plata.
En el apartado anterior se hizo mención de la increíble solubilidad del AgNO3 en agua. Esto implica que los iones Ag+ se disolverán sin ningún problema y estarán disponibles para interaccionar con cualquier ion del medio acuoso, tales como los aniones halogenuros (X= F–, Cl–, Br– y I–).
La plata como Ag+, y tras la adición de HNO3 diluido, precipita los fluoruros, cloruros, bromuros y yoduros presentes, los cuales consisten de sólidos blancuzcos o amarillentos:
Ag+(ac) + X−(ac) → AgX(s)
Esta técnica es muy recurrente para la obtención de los halogenuros, y se utiliza además en numerosos métodos analíticos cuantitativos.
El AgNO3 también desempeña un papel analítico en química orgánica, pues es el reactivo principal, junto al amoníaco, para la preparación del reactivo de Tollens. Este reactivo se utiliza en ensayos cualitativos que permiten determinar la presencia de aldehídos y cetonas en una muestra problema.
El AgNO3 es una excelente fuente de iones plata solubles. Esto, además de su relativo y bajo costo, lo vuelve un reactivo solicitado para infinidad de síntesis orgánicas e inorgánicas.
Sea cual fuera la reacción, si necesita de iones Ag+, entonces es bastante probable que los químicos recurran al AgNO3.
El AgNO3 llegó a tener mucho renombre en la medicina antes de la aparición de los antibióticos modernos. Hoy en día, no obstante, sigue utilizándose para casos específicos, pues posee propiedades cauterizantes y antibacterianas.
Por lo general, viene mezclado con KNO3 en la punta de unas varillas de madera, de modo que se reserva exclusivamente para usos tópicos. En este sentido, ha servido para el tratamiento de las verrugas, heridas, uñas infectadas, úlceras bucales y sangrados nasales. La mezcla AgNO3-KNO3 cauteriza la piel destruyendo el tejido dañado y las bacterias.
La acción bactericida del AgNO3 también se ha empleado en la purificación del agua.
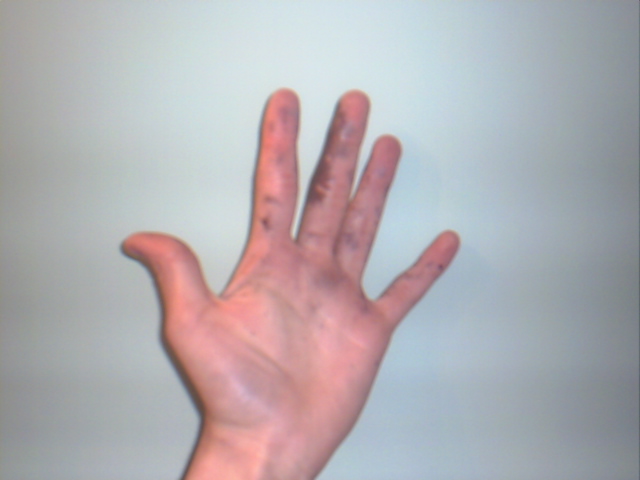
A pesar de que el nitrato de plata sea una sal estable y que no representa demasiados riesgos, es un sólido altamente cáustico, cuya ingestión puede provocar severos daños gastrointestinales.
Es por eso que se recomienda su manipulación con guantes. Puede quemar la piel, y en algunos casos, oscurecerla hasta tornarla morada, condición o enfermedad conocida como argiria.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Silver nitrate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Silver nitrate. PubChem Database., CID=24470. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Silver Nitrate. ScienceDirect. Recuperado de: sciencedirect.com
- University of Iowa. (2020). Silver nitrate use and toxicity. Recuperado de: medicine.uiowa.edu
- P.F. Lindley & P. Woodward. (1966). An X-ray investigation of silver nitrate: a unique metal nitrate structure. Journal of the Chemical Society A: Inorganic, Physical, Theoretical.
- Lucy Bell Young. (2020). What are the Medical Uses of Silver Nitrate. ReAgent Chemicals. Recuperado de: chemicals.co.uk
