Hidróxido de aluminio: estructura, propiedades, usos, riesgos
El hidróxido de aluminio es un compuesto inorgánico cuya fórmula química es Al(OH)3. A diferencia de otros hidróxidos metálicos, se trata de uno anfótero, capaz de reaccionar o comportarse como un ácido o una base, dependiendo del medio. Es un sólido blanco bastante insoluble en agua, por lo que encuentra uso como componente de los antiácidos.
Al igual que el Mg(OH)2 o la brucita, con el cual comparte ciertas características químicas y físicas, en forma pura luce como un sólido amorfo y sin brillo; pero cuando cristaliza con algunas impurezas adquiere formas cristalinas como si fueran perlas. Entre estos minerales, fuentes naturales de Al(OH)3, se encuentra la gibbsita.

Además de la gibbsita están también los minerales bayerita, nordstrandita y doleyíta, conformando los cuatro polimorfos del hidróxido de aluminio. Estructuralmente son muy similares unos de otros, diferenciándose apenas en el modo en cómo se sitúan o acoplan las capas o láminas de iones, así como el tipo de impurezas contenidas.
Controlando el pH y los parámetros de síntesis, pueden prepararse cualquiera de estos polimorfos. Asimismo, pueden intercalarse entre sus capas algunas especies químicas de interés, de manera que se crean materiales o compuestos de intercalación. Esto representa el uso de enfoque más tecnológico para el Al(OH)3. Sus demás usos son como antiácidos.
Por otra parte, se utiliza como materia prima para obtener alúmina, y sus nanopartículas se han utilizado como soporte catalítico.
Índice del artículo
La fórmula química Al(OH)3 indica de una vez que la relación Al3+:OH– es 1:3; es decir, que hay tres aniones OH– por cada catión Al3+, lo cual es igual a decir que la tercera parte de sus iones corresponde al aluminio. Así pues, el Al3+ y OH– interaccionan electrostáticamente hasta que sus atracciones-repulsiones definen un cristal hexagonal.
No obstante, el Al3+ no necesariamente está rodeado de tres OH– sino de seis; por lo tanto, se habla de un octaedro de coordinación, Al(OH)6, en el que hay seis interacciones Al-O. Cada octaedro representa una unidad con las que se construye el cristal, y un número de los mismos adoptan estructuras triclínicas o monoclínicas.
La imagen inferior representa parcialmente los octaedros Al(OH)6, ya que solo se observan cuatro interacciones para los Al3+ (esferas marrón claro).
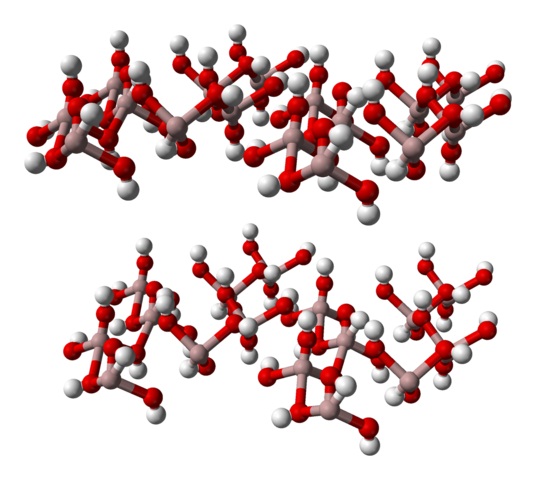
Si se observa detenidamente esta estructura, la cual corresponde a la del mineral gibbsita, podrá contemplarse que las esferas blancas integran las “caras” o superficies de las capas de iones; estas son, los átomos de hidrógeno de los iones OH–.
Nótese además que hay una capa A y otra B (espacialmente no son idénticas), unidas entre sí mediante puentes de hidrógeno.
Las capas A y B no se acoplan siempre de la misma manera, al igual que sus entornos físicos o los iones huéspedes (sales) pueden cambiar. En consecuencia, los cristales de Al(OH)3 varían en cuatro formas mineralógicas o, en este caso, polimórficas.
Se dice entonces que el hidróxido de aluminio presenta hasta cuatro polimorfos: gibbsita o hidrargilita (monoclínico), bayerita (monoclínico), doyleíta (triclínico) y nordstrandita (triclínico). De estos polimorfos, la gibbsita es el más estable y abundante; los demás son clasificados como minerales raros.
Si los cristales se observaran al microscopio, se vería que su geometría es hexagonal (aunque un tanto irregular). El pH juega un papel importante en el crecimiento de tales cristales y sobre la estructura resultante; es decir, dado un pH puede formarse un polimorfo u otro.
Por ejemplo, si el medio donde precipita el Al(OH)3 tiene un pH menor a 5,8 se forma gibbsita; mientras que si el pH es mayor que este valor, se forma la bayerita.
En medios más básicos, tiende a formarse cristales de nordstrandita y doyleíta. Así pues, al ser la gibbsita más abundante, es un hecho que refleja la acidez de sus ambientes meteorizados.
Sólido blanco que puede venir en diferentes formatos: granulado o en polvo, y de apariencia amorfa.
78.00 g/mol
2,42 g/mL
300 °C. No tiene punto de ebullición porque el hidróxido pierde agua para transformarse en la alúmina u óxido de aluminio, Al2O3.
1·10-4 g/100 mL. No obstante, su solubilidad aumenta con la adición de ácidos (H3O+) o álcalis (OH–).
Ksp = 3·10−34
Este valor tan pequeño significa que apenas una ínfima porción se disuelve en agua:
Al(OH)3(s) => Al3+(ac) + 3OH–(ac)
Y de hecho esta despreciable solubilidad lo vuelve un buen neutralizador de la acidez, ya que no basifica demasiado el medio gástrico por no liberar casi iones OH–.
El Al(OH)3 se caracteriza por su carácter anfótero; es decir, puede reaccionar o comportarse como si fuera un ácido o una base.
Por ejemplo, reacciona con los iones H3O+ (si el medio es acuoso) para formar el acuo complejo [Al(OH2)6]3+; que a su vez, se hidroliza para acidificar el medio, siendo por lo tanto el Al3+ un ion ácido:
Al(OH)3(s) + 3H3O+(ac) => [Al(OH2)6]3+(ac)
[Al(OH2)6]3+(ac) + H2O(l) => [Al(OH2)5(OH)]2+(ac) + H3O+(ac)
Al suceder esto, se dice que el Al(OH)3 se comporta como una base, ya que reacciona con el H3O+. Por otro lado, puede reaccionar con el OH–, comportándose como un ácido:
Al(OH)3(s) + OH–(ac) => Al(OH)4–(ac)
En esta reacción el precipitado blanco de Al(OH)3 se disuelve ante el exceso de iones OH–; hecho que no pasa igual con otros hidróxidos, como el de magnesio, Mg(OH)2.
El Al(OH)4–, ion aluminato, puede expresarse de manera más apropiada como: [Al(OH2)2(OH)4]–, destacando el número de coordinación de 6 para el catión Al3+ (el octaedro).
Este ion puede continuar reaccionando con más OH– hasta completar el octaedro de coordinación: [Al(OH)6]3-, llamado ion hexahidroxoaluminato.
El nombre ‘hidróxido de aluminio’, con el que más se ha hecho referencia a este compuesto, corresponde al regido por la nomenclatura stock. Se omite el (III) al final del mismo, ya que el estado de oxidación del aluminio es +3 en todos sus compuestos.
Los otros dos nombres posibles para referirse al Al(OH)3 son: trihidróxido de aluminio, de acuerdo a la nomenclatura sistemática y el uso de los prefijos numeradores griegos; e hidróxido alumínico, terminando con el sufijo –ico por tener un único estado de oxidación.
A pesar de que en el terreno químico la nomenclatura del Al(OH)3 no representa ningún desafío o confusión, fuera de él tiende a mezclarse con ambigüedades.
Por ejemplo, el mineral gibbsita es uno de los polimorfos naturales del Al(OH)3, al cual también nombran como γ-Al(OH)3 o α-Al(OH)3. Sin embargo, el α-Al(OH)3 también puede corresponder al mineral bayerita, o β-Al(OH)3, según la nomenclatura cristalográfica. Mientras, los polimorfos nordstrandita y doyleita suelen designarse simplemente como Al(OH)3.
La siguiente lista resume de manera clara lo recién explicado:
-Gibbsita: (γ o α)-Al(OH)3
-Bayerita: (α o β)-Al(OH)3
-Nordstrandita: Al(OH)3
-Doyleita: Al(OH)3
El uso inmediato para el hidróxido de aluminio es como materia prima para la producción de alúmina o de otros compuestos, inorgánicos u orgánicos, de aluminio; por ejemplo: AlCl3, Al(NO3)3, AlF3 o NaAl(OH)4.
Las nanopartículas de Al(OH)3 pueden actuar como soportes catalíticos; es decir, el catalizador se une a ellas para quedar fijas en su superficie, donde son aceleradas las reacciones químicas.
En el apartado de las estructuras se explicó que el Al(OH)3 consiste de capas o láminas A y B, acopladas para definir un cristal. Dentro del mismo, hay espacios o huecos octaédricos pequeños que pueden ser ocupados por otros iones, metálicos u orgánicos, o moléculas neutras.
Cuando se sintetizan cristales de Al(OH)3 con estas modificaciones estructurales, se dice que se está preparando un compuesto de intercalación; esto es, intercalan o meten especies químicas entre las láminas A y B. Al hacerlo, surgen nuevos materiales fabricados a partir de este hidróxido.
El Al(OH)3 es un buen retardante de fuego que encuentra aplicación como material de relleno de muchas matrices poliméricas. Esto se debe a que absorbe calor para liberar vapor de agua, tal como lo hace el Mg(OH)2 o la brucita.
El Al(OH)3 es además un neutralizador de la acidez, reaccionando con el HCl de las secreciones gástricas; nuevamente, de manera similar a como sucede con el Mg(OH)2 de la leche de magnesia.
Ambos hidróxidos de hecho pueden mezclarse en distintos antiácidos, utilizados para aliviar los síntomas de personas que padecen gastritis o ulceras estomacales.
Cuando se calienta por debajo de su punto de fusión, el hidróxido de aluminio se transforma en alúmina activada (así como carbón activado). Este sólido se utiliza como adsorbente de moléculas indeseables, ya sea colorantes, impurezas, o gases contaminantes.
Los riesgos que pueden representar el hidróxido de aluminio no se deben a él como sólido, sino como medicamento. No se necesita de ningún protocolo o normativas para almacenarlo, ya que no reacciona vigorosamente con agentes oxidantes, y tampoco es inflamable.
Cuando se ingiere en los antiácidos que se consiguen en las farmacias, pueden aparecer efectos secundarios indeseables, tales como estreñimiento e inhibición del fosfato de los intestinos. Asimismo, y aunque no hay estudios que lo demuestren, se le ha asociado con desórdenes neurológicos como la enfermedad del Alzheimer.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Aluminium hydroxide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Aluminum hydroxide. PubChem Database. CID=10176082. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Aluminum Hydroxide: Formula & Side Effects. Study. Recuperado de: study.com
- Robert Schoen & Charles E. Roberson. (1970). Structures of aluminum hydroxide and geochemical implications. The American Mineralogist, Vol 55.
- Vitaly P. Isupov & col. (2000). Synthesis, Structure, Properties, and Application of Aluminium Hydroxide Intercalation Compounds. Chemistry for Sustainable Development 8,121–127.
- Drugs. (24 de marzo de 2019). Aluminum hydroxide Side Effects. Recuperado de: drugs.com
