Radio: estructura, propiedades, usos, obtención
El radio es un elemento metálico perteneciente al grupo 2 de la tabla periódica, los metales alcalinotérreos, cuyo símbolo químico es Ra. Es el último miembro de este grupo, ubicándose por debajo del bario, y antecediendo a elementos radiactivos como el torio y el uranio; sin embargo, el radio es alrededor de un millón de veces más radiactivo y, por lo tanto, más peligroso que el mismo uranio.
Es un elemento rodeado de historias increíbles y lamentables, todo a consecuencia del desconocimiento de sus efectos negativos sobre la salud. El brillo azulado de sus sales y soluciones acuosas cautivó a los científicos Pierre y Marie Curie, quienes lo descubrieron en el año de 1898 analizando una inexplicable y fuerte radiación proveniente de muestras del mineral pechblenda, a las cuales les habían removido su contenido de uranio y polonio.

Eliminados el uranio y el polonio, los Curie y concluyeron que había otro elemento presente en la pechblenda, responsable de la fuerte radiación, la cual ingeniosamente pudieron cuantificar. Este nuevo elemento era químicamente muy parecido al bario; sin embargo, a diferencia de sus líneas verdes espectrales, las de este eran de un color carmín.
Así, después de procesar, purificar y analizar toneladas de pechblenda, obtuvieron 0.1 mg de RaCl2. Para entonces, en 1902, ya habían determinado la masa atómica del radio, cuyo nombre derivó de la palabra latina ‘radius’, que significa ‘rayo’. El radio, literalmente, es un elemento radiante.
Ocho más tarde, en 1910, Marie Curie junto con el químico francés André Louis Debierne, consiguieron aislar el radio en su forma metálica mediante la electrólisis del RaCl2 utilizando mercurio. Había nacido pues, la fiebre investigativa por el radio, que posteriormente devino en una alarmante sensación comercial, cultural y medicinal.
Índice del artículo
- 1 Estructura
- 2 Configuración electrónica
- 3 Propiedades del radio
- 4 Usos/aplicaciones del radio
- 5 Obtención
- 6 Isótopos
- 7 Referencias
El radio es un metal cuyos átomos son muy voluminosos. Una consecuencia de esto es que sus cristales son pocos densos (aunque ligeramente más que los de bario), y adoptan una estructura cúbica centrada en el cuerpo (bcc). Fuera de esta estructura, no se reportan ningún otro alótropo a otras temperaturas o presiones.
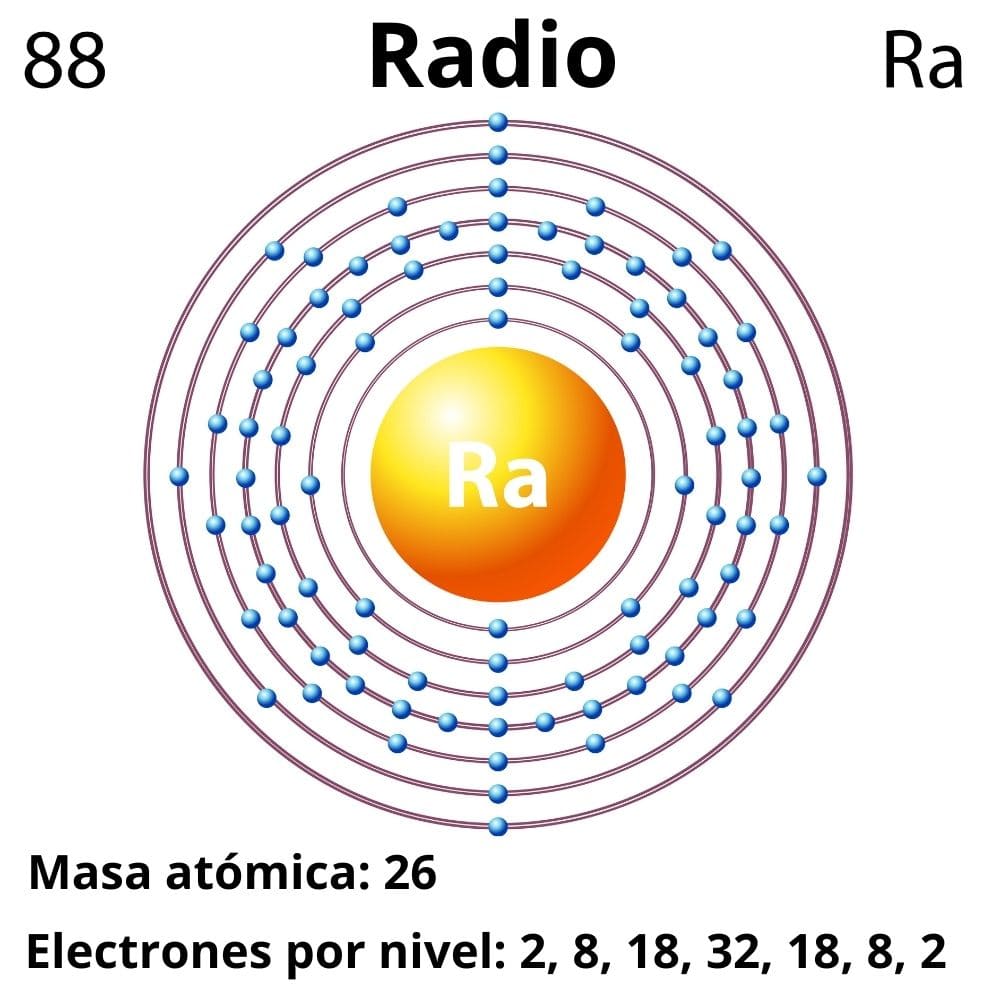
La configuración electrónica para el radio es la siguiente:
[Rn] 7s2
Se oxida con enorme facilidad para convertirse en el catión Ra2+, el cual es isoelectrónico al gas noble radón. Por lo tanto, todos los compuestos del radio contienen al catión Ra2+, estableciendo interacciones predominantemente iónicas; sin embargo, se calcula que es posible que, por efectos relativistas, pueda formar enlaces con notable carácter covalente (Ra—X).

El radio es un metal blanco plateado, que inmediatamente se tiñe de amarillo y se oscurece al reaccionar con el nitrógeno del aire para formar su nitruro, Ra3N2. Por ser tan difícil de manipular, son pocas las características físicas del radio que se han podido determinar directamente.
88
226.03 g/mol
Alrededor de los 700 ºC. Esta magnitud no ha podido determinarse con exactitud.
El radio hierve entre 1100 y 1700 ºC. Este grande margen de inexactitud refleja, nuevamente, las complicaciones de manipular un metal tan inestable.
5.5 g/cm3
8.5 kJ/mol
113 kJ/mol
El radio tiene un único estado de oxidación de +2.
0.9. Este valor corresponde fielmente al fuerte carácter electropositivo del radio.
Energías de ionización
Primera: 509.3 kJ/mol
Segunda: 979 kJ/mol
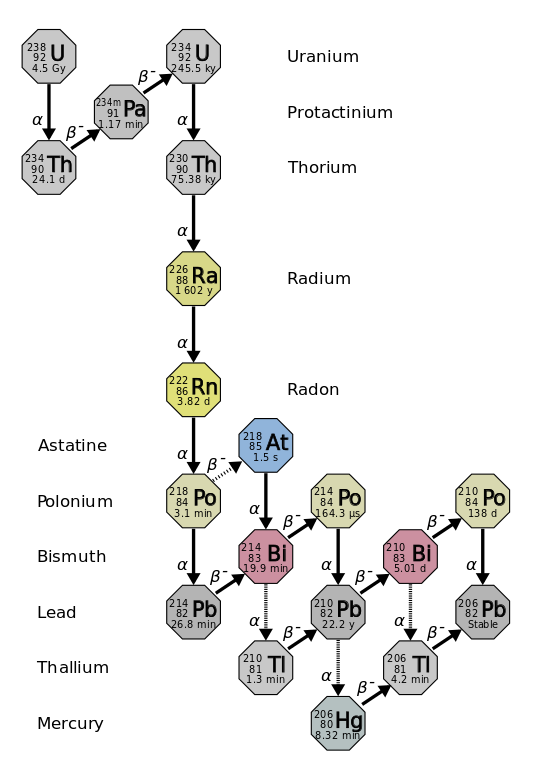
El radio es alrededor de un millón de veces más radiactivo que el uranio. Esto se debe principalmente al hecho de que a partir de él se producen otros isótopos, como el 222Rn (imagen superior), el cual a su vez decae emitiendo partículas α para transformarse en el isótopo 218Po. Una muestra de radio emite por lo tanto grandes cantidades de partículas α y β–, así como de rayos γ.
Por ejemplo, un gramo de radio, sufre 3.7·1010 desintegraciones por segundo, medida que sirvió para definir la unidad Ci, llamada curie. Esta energía es suficiente para calentar una muestra de 25 gramos de agua 1 ºC por hora.
Si se observa la cadena de decaimientos, se verá que el isótopo inicial, el 238U, tiene un t1/2 de 4.5 Giga años (miles de millones de años); mientras que en cambio, el 226Ra tiene un t1/2 de 1600 años, el cual además produce isótopos con t1/2 de apenas días, minutos y segundos.
La radiactividad del radio y sus compuestos es ionizante, por lo que las sustancias fluorescentes, incluso los átomos que los rodean, se iluminan durante la noche, llegando a ser capaz de desencadenar reacciones explosivas. Esta propiedad se conoce como radioluminiscencia.
Cuando las sales o compuestos de radio se calientan en un mechero despiden una llama color carmín. Tales sólidos por lo general son blancos o incoloros, pero se tiñen de amarillo y finalmente se oscurecen producto de la radiactividad de los átomos de radio. Si presentan impurezas de bario, pueden mostrar tonalidades rosadas.
La química del radio es muy parecida a la del bario, como si fueran dos hermanos inseparables, Ra-Ba. Ambos forman las mismas sales, insolubles en agua, con la diferencia de que las del radio son un poco más insolubles. Por ejemplo, el sulfato de radio, RaSO4, es más insoluble que el sulfato de bario, BaSO4; de hecho, es el sulfato más insoluble jamás conocido: 2.1 mg del mismo se disuelven apenas en 1 litro de agua.
Por otro lado, el hidróxido de radio, Ra(OH)2, es el más soluble y básico de todos los hidróxidos de sus congéneres.
En solución, los cationes Ra2+, en lugar de comportarse como ácidos de Lewis, son básicos, pues su gran tamaño imposibilita que las moléculas se acomoden a su alrededor para acomplejarlo o coordinarlo.
La analogía química entre el radio y el bario vuelve a este metal difícil de separar, debido a que sus sales coprecipitan con las del bario.

El uso más popular y controvertido del radio fue el de utilizarse como aditivo para las pinturas de las carátulas de los relojes. Sus átomos se incorporaban a las formulaciones pastosas del sulfuro de cinc, ZnS, el cual absorbía las emisiones radiactivas para desprender una luz verde y fosforescente. La pintura se aplicaba sobre las manecillas de los relojes (imagen superior).
El problema de este uso radicó en la continua exposición radiactiva que afectaba a los usuarios de estos relojes; o peor aún, a los trabajadores que los pintaban en las fábricas.
En 1924, varias empleadas que laboraban en una industria de pintura, conocidas después como las chicas del radio (Radium Girls), comenzaron a sufrir de cáncer de hueso, deformaciones de sus mandíbulas y pérdidas de dientes, debido a que tenían que lamer la punta de sus pinceles para poder aplicar provechosamente la pintura radiactiva sobre los relojes.
Esto, más el desconocimiento del radio, y la poca ética de no imponer medidas de protección que garantizaran la seguridad de los trabajadores, terminó en un escándalo legal que revolucionó las leyes de la seguridad ocupacional.
Las pinturas con radio dejaron de fabricarse en 1960; aunque hoy en día quedan varios ejemplares coleccionables que la tienen sobre sus superficies.

El Radithor fue uno de muchos productos farmacéuticos y cosméticos que pregonaban la eficiencia del radio para combatir mil y un males. Contenía una cantidad micrométrica de radio, la cual según debía curar todas las enfermedades digestivas y endocrinas. Sin embargo, en 1932, tras la muerte de Eden Byers, unos de sus más fervientes consumidores, el Radithor salió del mercado.
No todos los usos del radio fueron sensacionalistas, pseudocientíficos e inescrupulosos (o criminales). Los hubo también realmente beneficiosos para la salud, al menos hasta cierto tiempo. Las sales de radio, RaCl2 y RaBr2, se usan en el tratamiento contra el cáncer, específicamente el cáncer de hueso.
El isótopo 223Ra, al ser confundido por los iones de calcio en el metabolismo, termina destruyendo las células cancerígenas localizadas en el hueso.
No obstante, muchos de los usos terapéuticos del radio han sido reemplazados por isótopos más seguros, económicos y eficientes, tales como el 60Co y 137Cs.
El radio es uno de los elementos cuya producción es más escasa: apenas unos 100 gramos al año a nivel mundial. Toneladas de menas de uranio, como el mineral pechblenda (o uraninita) se procesan siguiendo el método de los Curie, el cual consiste en tratar las muestras con hidróxido de sodio, ácido clorhídrico y carbonato de sodio, de manera que se obtenía una mezcla de sulfatos de radio y bario, RaSO4-BaSO4.
La mezcla RaSO4-BaSO4 se transformaba en sus respectivos cloruros, RaCl2-BaCl2, separándose los cationes Ra2+ por cristalizaciones fraccionadas y purificándose finalmente empleando técnicas de cromatografía iónica. El RaCl2 se reduce mediante electrólisis, o reduciéndolo con aluminio metálico a 1200 ºC.
Todos los isótopos del radio son radiactivos. Cuatro de ellos existen en la naturaleza como productos del decaimiento radiactivo de átomos de 232Th, 235U y 238U.
Estos cuatro isótopos son: 223Ra (t1/2= 11.4 días), 224Ra (t1/2= 3.64 días), 226Ra (t1/2= 1600 años) y 228Ra (5.75 años). Evidentemente, casi todos los átomos de radio consisten de mezclas de los isótopos 226Ra y 228Ra, pues los otros se desintegran rápidamente.
El 226Ra es el más estable de todos los isótopos del radio, siendo todos los demás demasiado inestables, con t1/2 inferiores a las dos horas.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Radium. Recuperado de: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (2020). Radium. Recuperado de: britannica.com
- Radiactivity. (s.f.). Radium: the radioactive nucleus that made history. Recuperado de: radioactivity.eu.com
- Cantrill, V. (2018). The realities of radium. Nature Chem 10, 898. doi.org/10.1038/s41557-018-0114-8
- Elsevier B.V. (2020). Radium. ScienceDirect. Recuperado de: sciencedirect.com
