Darmstadtio: descubrimiento, estructura, propiedades, usos
El darmstadtio es un elemento químico ultra pesado ubicado en la serie de los transactínidos, los cuales comienzan justo después del metal lawrencio. Se sitúa específicamente en el grupo 10 y período 7 de la tabla periódica, siendo congéneres de los metales níquel, paladio y platino.
Tiene por símbolo químico Ds, con un número atómico de 110, y sus poquísimos átomos que se han sintetizado se descomponen prácticamente al instante. Es pues, un elemento efímero. Sintetizarlo y detectarlo representó una proeza en los años 90 del siglo pasado, llevándose el crédito de su descubrimiento un grupo de investigadores alemanes.

Antes de su descubrimiento y de que se debatiera cuál debía ser su nombre, el sistema de nomenclatura IUPAC le había formalmente nombrado como ‘ununilio’, que significa ‘uno-uno-cero’, igual a 110. Y más atrás de esta nomenclatura, de acuerdo al sistema de Mendeleev, su nombre era eka-platino por pensarse químicamente análogo a este metal.
El darmstadtio es un elemento no solo efímero e inestable, sino además altamente radiactivo, en cuyos decaimientos nucleares la mayoría de sus isótopos libera partículas alfas; estas son, núcleos desnudos de helio.
A causa de su tiempo de vida tan fugaz, todas sus propiedades son estimadas y nunca podrá utilizarse para algún fin en particular.
Índice del artículo
El problema entorno al descubrimiento del darmstadtio era que varios equipos de investigadores se habían dedicado a su síntesis en años sucesivos. Apenas se formaba su átomo, este se desvanecía en partículas irradiadas.
Por lo tanto, no se podía afirmar a tientas cuáles de los equipos merecían el crédito de haberlo sintetizado primero, cuando inclusive el detectarlo ya representaba un reto, decayendo tan rápido y liberando productos radiactivos.
En la síntesis del darmstadtio trabajaron por separados equipos de los siguientes centros investigativos: Instituto Central de Investigación Nuclear de Dubná (para entonces la Unión Soviética), Laboratorio Nacional Lawrence Berkeley (Estados Unidos) y Centro de Investigación de Iones Pesados (abreviado en alemán como GSI).
El GSI se localiza en la ciudad alemana de Darmstadt, donde en noviembre de 1994 sintetizaron el isótopo radiactivo 269Ds. Los otros equipos sintetizaron otros isótopos: 267Ds en el ICIN, y 273Ds en el LNLB; sin embargo, sus resultados no habían sido concluyentes a los ojos críticos de la IUPAC.
Cada equipo había propuesto un nombre particular para este nuevo elemento: hahnio (ICIN) y bequerelio (LNLB). Pero tras un informe de la IUPAC en el año 2001, el equipo alemán del GSI tuvo el derecho de nombrar al elemento como darmstadtio.
El darmstadtio es producto de la fusión de átomos metálicos. ¿Cuáles? En principio, uno relativamente pesado que sirva como blanco u objetivo, y otro liviano que se le hará colisionar contra el primero a una velocidad igual a la décima parte de la velocidad de la luz en el vacío; de lo contrario, no se podría vencer las repulsiones existentes entre sus dos núcleos.
Una vez los dos núcleos colisionen eficientemente, ocurrirá una reacción nuclear de fusión. Los protones se suman, pero el destino de los neutrones es distinto. Por ejemplo, el GSI desarrolló la siguiente reacción nuclear, de la cual se produjo el primer átomo 269Ds:
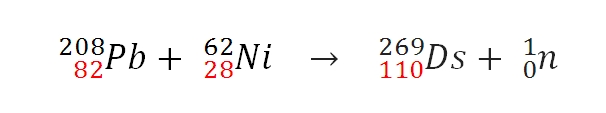
Nótese que los protones (en rojo) se suman. Variando las masas atómicas de los átomos colisionados, se obtienen diferentes isótopos de darmstadtio. De hecho, el GSI realizó experimentos con el isótopo 64Ni en lugar del 62Ni, de los que sintetizaron apenas 9 átomos del isótopo 271Ds.
El GSI logró crear 3 átomos de 269Ds, pero después de ejecutar tres trillones de bombardeos por segundo durante una semana completa. Este dato ofrece una abrumadora perspectiva de las dimensiones de semejantes experimentos.
Debido a que solo puede sintetizarse o crearse un átomo de darmstadtio por semana, es improbable que se cuente con los suficientes para que puedan establecer un cristal; sin mencionar que el isótopo más estable es el 281Ds, cuyo t1/2 es de tan solo 12,7 segundos.
Por lo tanto, para determinar su estructura cristalina los investigadores se basan en cálculos y estimaciones que buscan acercarse al panorama más real. Así, se ha estimado que la estructura del darmstadtio es cúbica centrada en el cuerpo (bcc); a diferencia de las de sus congéneres más livianos níquel, paladio y platino, con estructuras cúbica centrada en las caras (fcc).
En teoría, deben participar en su enlace metálico los electrones más externos de los orbitales 6d y 7s, de acuerdo a su también estimada configuración electrónica:
[Rn]5f146d87s2
No obstante, probablemente poco logre saberse experimentalmente de las propiedades físicas de este metal.

Las demás propiedades del darmstadtio también son estimadas, por las mismas razones mencionadas para su estructura. Sin embargo, algunas de estas estimaciones resultan interesantes. Por ejemplo, el darmstadtio sería un metal aún más noble que el oro, así como mucho más denso (34,8 g/cm3) que el osmio (22,59 g/cm3) y el mercurio (13,6 g/cm3).
Respecto a sus posibles estados de oxidación, se ha estimado que serían +6 (Ds6+), +4 (Ds4+) y +2 (Ds2+), iguales a los de sus congéneres más livianos. Por lo tanto, si se hicieran reaccionar los átomos de 281Ds antes de que se desintegraran, se obtendrían compuestos tales como el DsF6 o DsCl4.
Sorprendentemente, sí existe la probabilidad de sintetizar estos compuestos, debido a que 12,7 segundos, el t1/2 del 281Ds, es tiempo más que suficiente para realizar las reacciones. No obstante, el inconveniente continúa siendo que con solo un átomo de Ds a la semana es insuficiente para recopilar todos los datos que exige un análisis estadístico.
Nuevamente, por ser un metal tan escaso, actualmente sintetizado en cantidades atómicas y no masivas, no hay ningún uso reservado para él; ni siquiera en un futuro lejano.
A menos que se invente un método para estabilizar sus isótopos radiactivos, los átomos de darmstadtio solamente servirán para despertar la curiosidad científica, especialmente en lo que concierne a la física y química nuclear.
Pero si se ingenia algún modo de crearlos en abundantes cantidades, más luces se arrojarán sobre la química de este ultra pesado y efímero elemento.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Darmstadtium. Recuperado de: en.wikipedia.org
- Steve Gagnon. (s.f.). The Element Darmstadtium. Jefferson Lab Resources. Recuperado de: education.jlab.org
- National Center for Biotechnology Information. (2020). Darmstadtium. PubChem Database. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (15 de diciembre de 2019). Darmstadtium. Chemistry in its elements. Recuperado de: chemistryworld.com
