Tabla cuántica: qué es, características, para qué sirve, usos
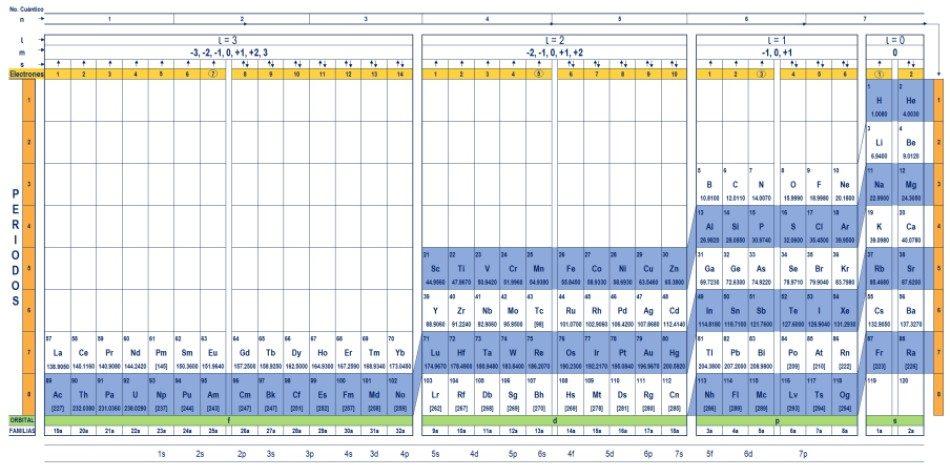
¿Qué es la tabla cuántica?
La tabla cuántica es una forma de organizar los elementos químicos, diseñada para determinar fácilmente el conjunto de números cuánticos que caracteriza a cada uno de ellos.
Los científicos han encontrado que, en la naturaleza de todos los elementos, existen determinados patrones. Entre estos patrones se encuentran los números cuánticos, cuatro números sencillos que describen la configuración electrónica de cada elemento.
Los números cuánticos surgen de forma natural a partir del modelo mecánico-cuántico del átomo y se denotan mediante letras: n, ℓ, mℓ y s. Ellos describen el estado de energía de los electrones en el átomo de cada elemento químico.
A través de la tabla periódica tradicional, y algunas herramientas adicionales, es posible tener la configuración electrónica del átomo de cualquier elemento. La ventaja de la tabla cuántica es que los elementos se organizan de tal manera, que sus números cuánticos son visibles de inmediato, sin necesidad de hacer numerosos cálculos aparte.
Características de la tabla cuántica
Existen varios diseños de tablas cuánticas. El modelo mostrado en la figura de arriba contiene:
- Un encabezado con cuatro filas, con los valores de los cuatro números cuánticos, n, ℓ, m y s, más una quinta fila en amarillo, que corresponde al número de electrones en el orbital más externo.
- El cuerpo de la tabla, que consiste en una cuadrícula que contiene el símbolo del elemento químico, comenzando con el hidrógeno, en la penúltima columna de la derecha, seguido del helio, y así sucesivamente. El número debajo representa la cantidad de electrones del átomo en estado fundamental.
- En la parte de abajo, en la fila verde hay cuatro clases para organizar a los elementos: los orbitales s, p, d y f (de izquierda a derecha).
- Por último, debajo de la fila de orbitales está la familia. Cada columna es una familia, numerada desde el 1 hasta el 32. Por ejemplo, las familias 1a y 2a pertenecen a la clase s, las familias desde la 3a hasta la 8a, pertenecen a la clase p, y así sucesivamente.
¿Para qué sirve la tabla cuántica?
La tabla cuántica sirve para hallar el conjunto de números cuánticos que caracteriza a un electrón del átomo. Normalmente, estos electrones serán los de la capa más externa, puesto que son los que definen el comportamiento químico del elemento.
¿Cómo se usa la tabla cuántica?
La tabla cuántica permite encontrar fácilmente los números cuánticos de los electrones en la capa más externa del átomo.
Ejemplo 1
Para ilustrar el procedimiento, se toma como ejemplo el elemento aluminio, cuyo símbolo es Al. El primer paso es ubicarlo en la tabla cuántica, marcándolo con un círculo rojo:
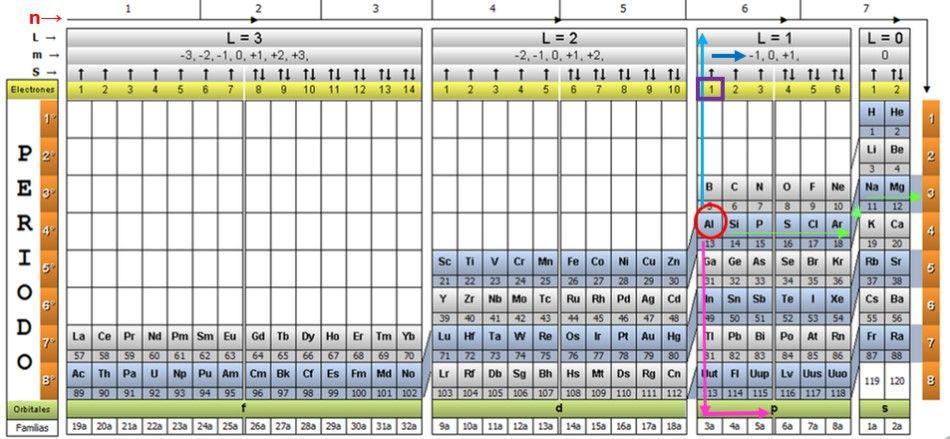
Paso 1: hallar n
Tras ubicar al elemento en la tabla, hay que desplazarse por esa misma fila y color, hacia la derecha, hasta llegar a la columna de color naranja, siguiendo el camino de la flecha verde mostrado en la imagen.
La flecha apunta a la casilla marcada con el número 3, el cual es el número cuántico principal n:
n = 3
Paso 2: hallar ℓ
Para determinar el número cuántico secundario, se sigue la flecha vertical azul, que indica:
ℓ = 1.
Paso 3: hallar m
El electrón externo del aluminio se encuentra en la familia del subnivel p, como puede leerse en la fila verde de abajo, a la que apunta la flecha rosa.
Además, la cantidad de electrones en la última capa se lee en la fila amarilla del encabezado. En el caso del aluminio hay 1 electrón (destacado en el cuadrado morado), que es el de referencia. Combinando los resultados anteriores, la configuración de la última capa resulta:
3p1
Se sabe que una capa p admite un máximo de 6 electrones. Y el número m toma alguno de los valores enteros − ℓ , (− ℓ+1), …0, … (+ℓ −1), +ℓ.
Como en este caso ℓ = 1, entonces m puede ser −1, 0, 1.
Estos números aparecen en la fila del encabezado correspondiente a m (ver en la imagen la flecha horizontal azul). El siguiente cuadro sirve de guía para saber cuál es el valor de m a escoger, según el caso:

Dado que la última capa del aluminio tiene 1 electrón, se corresponde el número cuántico magnético
m = 1.
Paso 4: hallar s
El número de espín s solo tiene dos valores: +½ o – ½. En el cuadro de arriba, si la flecha señala hacia arriba, se escoge s = +½ y si apunta hacia abajo, entonces s = – ½. En el caso del aluminio, el electrón 1 apunta hacia arriba, por lo tanto:
s = + ½.
Resumiendo, los números cuánticos del electrón de la capa más externa del aluminio Al son:
n = 3; ℓ = 1; m = 1, s = +½
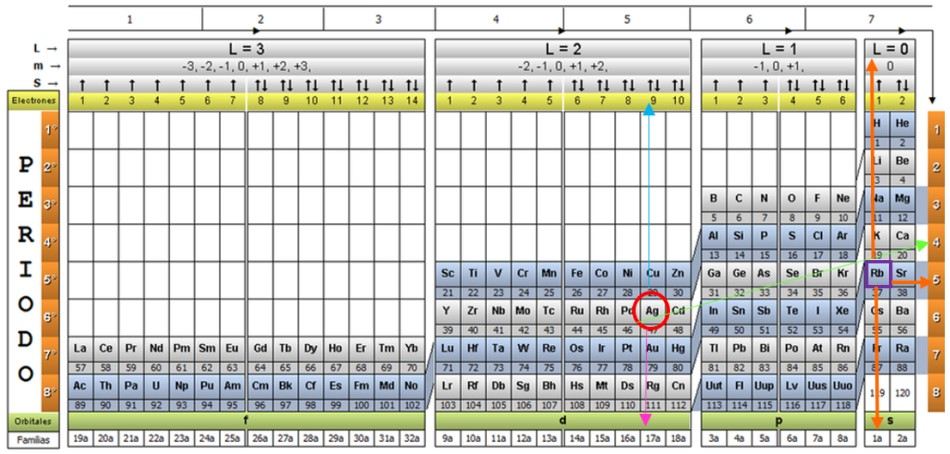
Ejemplo 2 (casos excepcionales)
La plata Ag, y una veintena de elementos más, son casos excepcionales, por lo que se debe tener cuidado al emplear la tabla cuántica con ellos.
Si se repite el procedimiento anterior, se obtendría para Ag como último subnivel el 4d9.
Esto se debe a que la configuración predicha de la plata, por la regla de Madelung, es:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9
Sin embargo, en la práctica Ag no sigue exactamente esta configuración, ni tampoco lo hace ningún otro de los elementos cuya última capa predicha sea 4d9, como el cobre y el oro, entre otros (consultar internet para obtener una lista completa de elementos que no siguen la regla de Madelung).
La configuración real de Ag es:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
En la que un electrón de la capa 5s2 saltó a la capa 4d9 para completarla. De esta manera aumenta la estabilidad del átomo. Por lo tanto, el último subnivel realmente es:
5s1
Y sus números cuánticos serían los correspondientes al elemento Rb, mostrado en un cuadro morado, con flechas naranja señalando los restantes números:
n= 5; ℓ = 0; m = 0; s = +½
Diferencias con la tabla periódica
Ambas tablas son dos maneras de organizar los elementos químicos según las características de sus átomos:
-En la tabla periódica, los elementos que se encuentran en la misma columna tienen propiedades químicas semejantes. Por ejemplo, comienza con la columna de los metales alcalinos a la izquierda y termina con la de los gases nobles a la derecha. Mientras que en las filas están los elementos con el mismo nivel superior de energía.
-La tabla cuántica tiene una disposición escalonada, diseñada según las reglas de llenado. Por ello hay que seguir los escalones para obtener el número cuántico principal, salvo en el caso de las excepciones como la plata, en el ejemplo de la sección anterior. Las familias de elementos en esta tabla están relacionados a través del orbital superior, en s, p, d o f.
Referencias
- Chang, R. 2013. Química. 11va. Edición. McGraw Hill Educación.
- Configuración Electrónica. Configuración electrónica y números cuánticos. Recuperado de: configuracionelectronica.com.
- Manual de Química. Recuperado de: dcb.ingenieria.unam.mx.
- Químicaoficial. Cómo calcular fácil los números cuánticos. Recuperado de: quimicaoficial.com
- Triplenlace. Excepciones a la regla de Madelung en la configuración electrónica de los elementos químicos. Recuperado de: triplenlace.com.
