Miosina: características, estructura, tipos y función
La miosina es un motor molecular, de naturaleza proteica, capaz de desplazarse sobre filamentos de actina en el citosol. La energía que impulsa el desplazamiento de la miosina proviene de la hidrólisis del ATP. Debido a ello, la miosina suele definirse como una enzima mecanoquímica.
En los eucariotas, la miosina es una proteína muy abundante. Existen diferentes clases de miosina, las cuales están codificadas por una familia de genes. En levaduras, se distinguen 5 clases, mientras que en mamíferos se han descrito decenas.
La miosina posee una gran variedad de funciones. La miosina I, junto a la actina, participa en el movimiento de los queratocitos.
La miosina II proporciona rigidez a la membrana plasmática, participa en la citocinesis y en la contracción muscular. Ambas, miosinas I y II, colaboran con la migración celular. Las miosinas I y V realizan el transporte de vesículas a lo largo de los filamentos de actina.
Índice del artículo
En micrografías electrónicas, la estructura típica de las isoformas de miosina tiene tres dominios: cabeza, cuello y cola. Mediante hidrólisis con quimotripsina, se obtiene un segmento que consta de cabeza y cuello, denominado meromiosina pesada (HMM), y un segmento de la cola, denominado meromiosina liviana (LMM).
El dominio de la cabeza es el extremo N–terminal de la cadena pesada, y el dominio de la cola es el extremo C–terminal de la cadena liviana.
Las clases de miosina pueden diferenciarse por el número de cadenas polipeptícicas que la componen, y la abundancia y clase de cadena liviana unida al cuello.
La miosina I tiene una cadena polipeptídica, que forma una cabeza y su cola carece de regiones alfa helicoidales. Mientras que las miosinas I y V tienen dos cadenas polipeptídicas, y por ende forma dos cabezas y una cola, en la cual las cadenas alfa helicoidales se arrollan para formar una estructura similar a un bastón.
Las miosinas I y V poseen sitios de unión a la calmodulina, que regula y fija Ca+2, en las cadenas livianas. La miosina I fija Ca+2 en las cadenas livianas, pero lo hace de forma diferente a la calmodulina.
A nivel mecanoquímico las miosinas poseen tres características, a saber:
– La cabeza de miosina es el dominio motor que avanza a pasos discretos: La unión de la cabeza de miosina a un filamento de actina, su inclinación y posterior separación producen el movimiento de la miosina. Este proceso es cíclico y depende de ATP.
– Cambios de conformación: la hidrólisis de una molécula de ATP está acoplada a cada paso de una molécula de miosina, mediante niveles de amplificación y transmisión. Esto implica cambios conformacionales grandes de la miosina.
El primer nivel de amplificación, se produce por la pérdida del grupo gamma-fosfato del ATP, lo que permite una reorganización de los elementos estructurales en el sitio de unión al ATP. Esta reorganización es coordinada con cambios estructurales en el sitio de unión a la actina.
El segundo nivel de amplificación implica la comunicación del cambio conformacional en el sitio activo a componentes estructurales del carboxilo terminal.
– Direccionalidad: se ha encontrado que las miosinas poseen una polaridad, o direccionalidad reversa, hacia el extremo (+) del filamento de actina. Esta conclusión procede de los experimentos de deslizamiento del filamento de actina, usando microscopio óptico de fluorescencia.
La miosina, junto a la actina, participa en la contracción muscular, la adhesión celular, la citocinesis, el otorgamiento de rigidez a las membranas corticales y el desplazamiento de algunas vesículas, entre otras funciones.
Los defectos en la miosina pueden producir condiciones patológicas. Por ejemplo, los defectos en las miosinas I y V están relacionados, respectivamente, con miopatías de miosina y desórdenes de la pigmentación (Síndrome de Griscelli). Mientras que los desórdenes en isoformas de miosina VI ocasionan pérdida del oído.
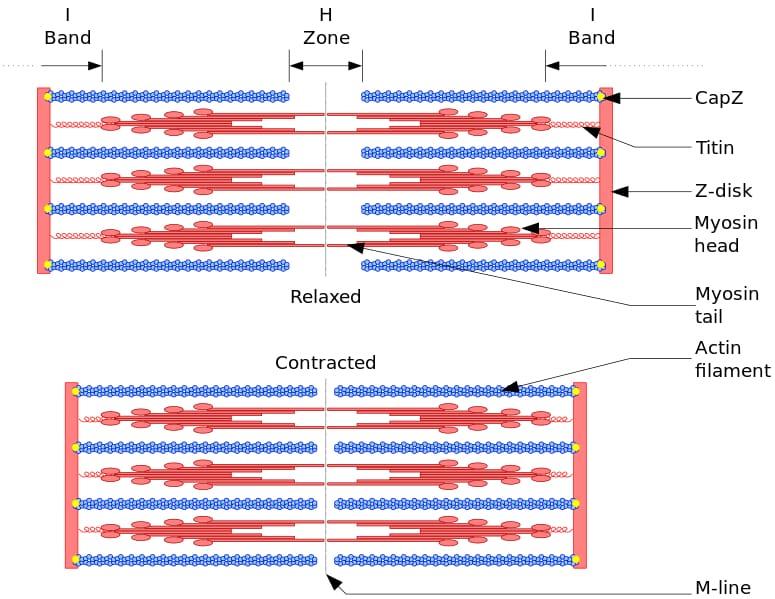
La unidad funcional y estructural del músculo esquelético es el sarcómero. Durante la contracción muscular, la longitud del sarcómero alcanza el 30% de su longitud original.
Los sarcómeros están constituidos por filamentos gruesos, de miosina, y filamentos delgados, de actina, que se hallan organizados de forma compleja. De manera general, las cabezas de miosina se ubican en los extremos distales del filamento y sus colas hacia el centro del sarcómero, y la organización es bipolar.
Para que ocurra la contracción muscular, las cabezas de miosina, de los extremos opuestos, se deben desplazar hacia el disco Z o el extremo (+) del filamento. Debido a que la organización de los filamentos gruesos es bipolar, ocurre el deslizamiento de los filamentos delgados sobre los filamentos gruesos, impulsado por ATP.
La fuerza de desplazamiento se produce porque centenares de cabezas de miosina, de un filamento grueso, interactúan con un filamento delgado.
Durante la mitosis, cuando los microtúbulos de los polos del huso se separan, la actina y la miosina II forman un anillo contráctil en el ecuador de la célula. Este anillo se contrae disminuyendo su diámetro y dividiendo la célula en dos partes.
En las células mutantes que carecen de miosina II, la membrana plasmática se deforma fácilmente cuando se le aplica una fuerza externa. Esto sucede porque la miosina II proporciona fuerza de agregación a las proteínas de la membrana plasmática.
En el tejido epitelial, los haces contráctiles de actina y miosina II se ubican en las vecindades de la membrana plasmática, y forman un cinto circular que rodea la superficie interior celular. Este cinto circular determina la forma de la célula y mantiene la unión entre las células.
El contacto entre células ocurre por la unión del cinto circular a las moléculas de adhesión celular, mediante proteínas de unión.
Evidencia experimental revela que la miosina V realiza transporte de membrana desde el aparato de Golgi hacia la periferia de la célula. Algunas evidencias son:
– En células de tejido nervioso, mediante inmunofluorescencia de astrocitos se encontró que la miosina V se ubica junto al Golgi.
– En levaduras, las mutaciones en el gen de la miosina V interrumpe la secreción de proteínas y, en consecuencia, se acumulan proteínas en el citosol.
– Las isoformas de la miosina I se encargan del transporte de vacuolas hacia la membrana celular. Usando anticuerpos específicos contra isoformas de la miosina I, se encontró que dichas isoformas se encuentran localizadas en diferentes partes de la célula.
Por ejemplo, cuando una ameba viva es marcada con un anticuerpo contra la miosina IC, el transporte de la vacuola hacia la membrana es detenido. Debido a ello, la vacuola se expande y la célula estalla.
Hay numerosos genes y mutaciones que producen la pérdida de oído. Esta enfermedad es frecuentemente monogenética .
Las mutaciones en miosinas no convencionales, con una o dos cabezas de miosina, afectan el funcionamiento del oído interno. Algunas de las isoformas de miosina mutadas son miosina IIIA, miosina VIIA y miosina XVA. Recientemente, se descubrieron dos mutaciones en la miosina VI.
Las mutaciones en la miosina VI son c.897G>T y p.926Q. La primera mutación afecta a una región que interactúa con el sito activo, denominado Switch I. Los homocigotos para la mutación exhiben tempranamente el fenotipo, provocando efectos severos.
La segunda mutación afecta una región de residuos con carga, en una hélice alfa en la cola de la miosina VI. Esta región es importante para la dimerización proximal del motor, y afecta la función estereo–ciliar de la miosina VI.
Otra mutación es p.Asn207Ser, que produce un motor incapaz de producir fuerza. Esto se debe a que Asn 207 es un residuo de aminoácido del sitio activo, cuya función es la unión e hidrólisis del ATP.
La mutación p.Arg657Trp produce la pérdida de la función de la miosina VI. El residuo Arg está implicado en los cambios conformacionales que acoplan la hidrólisis al movimiento de la miosina.
La miosina X (Myo10) es una miosina no convencional que se expresa en el cerebro, endotelios y muchos epitelios. Myo10 y tres clases de proyecciones basadas en actina (filopodios, invadopodia y proyecciones parecidas a filopodios) funcionan durante la metástasis del cáncer.
Las células invasivas del cáncer tienen un gran número de filopodios y expresan altos niveles de fascina. Esta proteína realiza entrecruzamientos entre filamentos de actina. Con la finalidad de escapar del tumor primario, se forman invadopodios, ricos en actividad proteolítica, que digieren a la matriz extracelular circundante.
Una vez que las células alcanzan la matriz extracelular, las proyecciones similares a filopodios ayudan a dispersarse y colonizar. Altos niveles de Myo10 indican alta agresividad y metástasis en el cáncer de seno.
El silenciamiento de MyoX produce pérdida del carácter metastásico de las células, las cuales son incapaces de formar las proyecciones basadas en actina. Todas estas proyecciones poseen adhesiones basadas en integrina, las cuales son transportadas por Myo10 dentro del filopodio.
MyoX está implicada en la formación del centrosoma. La ausencia de MyoX favorece la formación de husos multipolares. MyoX también está implicada en el señalamiento en células cancerígenas. Por ejemplo, MyoX es activada por 3,4,5,–trifosfato de inositol (PIP3).
- Alberts, B., Johnson, A., Lewis, J., y col. 2007. Molecular Biology of the Cell. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham, K. 2014. Novel myosin mutations for hereditary hearing loss revealed by targeted genomic capture and massively parallel sequencing. European Journal of Human Genetics, 22: 768 –775.
- Courson, D.S. and Cheney, R.E. 2015. Myosin-X and Disease. Experimental Cell Research, 334: 10–15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biología celular y molecular. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, México, Sāo Paulo.
- Schliwa, M. and Woehlke, G. 2003. Molecular motors. Nature, 422: 759 – 765.
- Vale, R.D. 2003. The Molecular Motor Toolbox for Intracellular Transport. Cell, 112: 467– 480.
