Ácido sulfónico: estructura, nomenclatura, propiedades, usos
Se denomina ácido sulfónico a todo compuesto perteneciente a una familia de ácidos orgánicos que poseen uno o más grupos –SO3H. Ciertos autores indican que el compuesto padre es el H–S(=O)2–OH, o H–SO3H, denominado por algunos “ácido sulfónico”, sin embargo, no se ha comprobado su existencia, ni la de su tautómero HO–S(=O)–OH conocido como “ácido sulfuroso” (H2SO3), ni en solución ni en estado sólido.
Esto último se debe a que el gas dióxido de azufre (IV) (SO2) en solución acuosa se convierte en iones bisulfito (HSO3–) y pirosulfito (S2O52–) y no a H–S(=O)2–OH ni a HO–S(=O)–OH, lo cual ha sido ya comprobado por muchos investigadores químicos.
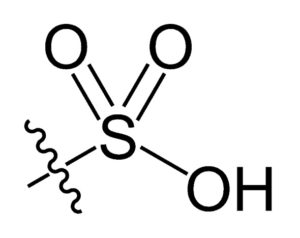
En la fórmula química R-SO3H de los ácidos sulfónicos, el grupo R puede representar esqueletos hidrocarbonados como alcano, alqueno, alquino y/o areno. Estos pueden contener funcionalidades secundarias como grupos éster, éter, cetona, amino, amido, hidroxilo, carboxilo y fenol, entre muchos otros.
Los ácidos sulfónicos son ácidos fuertes, comparables al ácido sulfúrico (H2SO4). Sin embargo, el resto de sus propiedades depende en gran parte de la naturaleza del grupo R.
Algunos tienen tendencia a desulfonar a altas temperaturas. Esto significa perder el grupo –SO3H, especialmente cuando R es un areno, es decir, con anillo bencénico.
Los ácidos sulfónicos tienen muchos usos dependiendo de su fórmula química. Se usan para fabricar colorantes, tintas, polímeros, detergentes, surfactantes y como catalizadores, entre muchas otras aplicaciones.
Índice del artículo
Los ácidos sulfónicos tienen la siguiente estructura general:
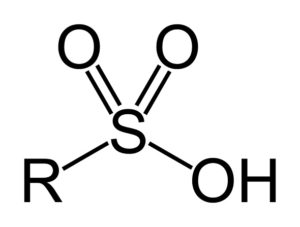
– Grupo sulfonilo: –SO3H
– Ácido alquil o arilsulfónico: R–SO3H
Son sólidos o líquidos dependiendo del grupo R. No se conocen ácidos sulfónicos gaseosos.
Sus propiedades físicas y químicas dependen de la naturaleza del grupo R. A manera de comparación se presentan algunas propiedades físicas de varios ácidos sulfónicos, donde p.f. es el punto de fusión y p.e. es el punto de ebullición a una presión de 1 mm Hg:
– Ácido metanosulfónico: p.f. 20 ºC; p.e. 122 ºC
– Ácido etanosulfónico: p.f. -17 ºC; p.e. 123 ºC
– Ácido propanosulfónico: p.f. -37 ºC; p.e. 159 ºC
– Ácido butanosulfónico: p.f. -15 ºC; p.e. 149 ºC
– Ácido pentanosulfónico: p.f. -16 ºC; p.e. 163 ºC
– Ácido hexanosulfónico: p.f. 16 ºC; p.e. 174 ºC
– Ácido bencenosulfónico: p.f. 44 ºC; p.e. 172 ºC (a 0,1 mm Hg)
– Ácido p-toluensulfónico: p.f. 106 ºC; p.e. 182 ºC (a 0,1 mm Hg)
– Ácido 1-naftalensulfónico: p.f. 78 ºC; p.e. se descompone
– Ácido 2-naftalensulfónico: p.f. 91 ºC; p.e. se descompone
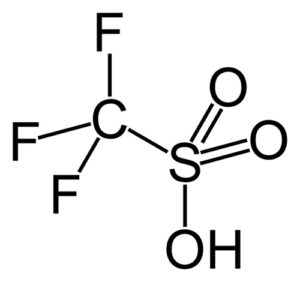
– Ácido trifluorometanosulfónico: p.f. ninguno; p.e. 162 ºC (a 760 mm Hg)
La mayoría son muy solubles en agua.
Los ácidos sulfónicos son aún más ácidos que los ácidos carboxílicos. Tienen acidez similar a la del ácido sulfúrico. Se disuelven en hidróxido de sodio acuoso y en bicarbonato acuoso.
Tienden a sufrir descomposición térmica, ocurriendo su desulfonación. Sin embargo, varios de los ácidos alcanosulfónicos son estables térmicamente. En particular, el ácido tríflico, o ácido trifluorometanosulfónico, es uno de los ácidos más fuertes y más estables.
Los ácidos arilsulfónicos se obtienen generalmente mediante el proceso de sulfonación que consiste en añadir un exceso de ácido sulfúrico fumante (H2SO4 + SO3) al compuesto orgánico que deseamos sulfonar. Por ejemplo en el caso del benceno:
C6H6 + H2SO4 ———> C6H5SO3H + H2O
ArH + H2SO4 ———> ArSO3H + H2O
La sulfonación es una reacción reversible, pues si agregamos al ácido bencenosulfónico un ácido diluido y pasamos vapor sobre la mezcla, se va generando la reacción de eliminación del SO3 y se va destilando el benceno mediante volatilización con el vapor, desplazando el equilibrio hacia la desulfonación.
El agente sulfonante también puede ser ácido clorosulfúrico, ácido sulfámico o iones sulfito.
Estos generalmente se preparan mediante sulfo-oxidación, esto es, tratamiento de compuestos alquílicos con dióxido de azufre SO2 y oxígeno O2, o directamente con trióxido de azufre SO3.
RH + 2SO2 + O2 + H2O ———-> R-SO3H + H2SO4
Los ácidos alquilbencenosulfónicos se emplean en la manufactura de detergentes, siendo uno de los usos más extendidos.
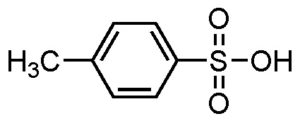
Se usan para detergentes en polvo y líquidos, detergentes para tareas pesadas o livianas, jabones para las manos y champú.
Los componentes activos generalmente son los alquilbencenosulfonatos lineales y ésteres grasos sulfonados.
Como surfactantes son comunes los sulfonatos de alfa-olefinas, las sulfobetaínas, los sulfosuccinatos y los disulfonatos de éteres alquil difenílicos, todos los cuales son derivados de ácidos sulfónicos.
Estos surfactantes encuentran uso en productos de limpieza del hogar, cosméticos, polimerización en emulsiones y manufactura de químicos para la agricultura.
Los lignosulfonatos son derivados sulfonados de la lignina, un componente de la madera, y se usan como agentes dispersantes, humectantes, aglutinantes en pavimentos de carreteras, aditivos para concreto y aditivos en alimentos para animales.
Un derivado del ácido 2-naftalenosulfónico se utiliza para aumentar la fluidez y fuerza del cemento.
Estos generalmente se caracterizan por contener grupos azo (R–N=N–R).
Los colorantes derivados de ácidos sulfónicos poseen utilidad en la industria del papel, tintas como las de impresión por inyección, textiles como algodón y lana, cosméticos, jabones, detergentes, alimentos y cuero.
También se emplea un derivado del ácido 2-naftalenosulfónico como ingrediente de colorantes para fibras de poliéster y para el curtido de cuero.
En esta aplicación se destacan los ácidos acrilamidosulfónicos, los cuales tienen uso en polímeros, en electrodeposición de metales, como surfactantes y en recubrimientos antiempañantes transparentes.
También se emplean en recuperación mejorada de petróleo, como agentes liberadores de compuestos en suelo, en mezclas de cemento hidráulico y como aceleradores de curado de resinas aminoplásticas.
Algunas sulfonamidas también se utilizan en fórmulas de insecticidas.
En este grupo destaca el ácido trifluorometanosulfónico (CF3SO3H), llamado también ácido tríflico. Este compuesto tiene aplicación en síntesis orgánica y catálisis de reacciones de polimerización.
Por ejemplo, se utiliza en la polimerización de olefinas aromáticas y en la preparación de hidrocarburos parafínicos altamente ramificados con un alto número de octano para usarlos como aditivos de combustibles.
Otra de sus aplicaciones es en la síntesis de polímeros conductores, mediante el dopaje de poliacetileno, produciendo por ejemplo semiconductores tipo p.
El ácido pentafluoroetanosulfónico (CF3CF2SO3H), conocido como ácido pentáflico, es empleado como catalizador orgánico.
El ácido tríflico se hace reaccionar con pentafluoruro de antimonio (SbF5) generando el llamado “Ácido Mágico”, un catalizador superácido que sirve para alquilación y polimerización.
El Nafion-H es una resina de intercambio iónico de un ácido sulfónico polimérico perfluorado. Posee la característica de ser inerte hacia ácidos fuertes, bases fuertes y agentes reductores u oxidantes.
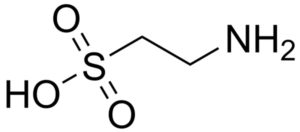
Uno de los pocos ácidos sulfónicos que se encuentran en la naturaleza es el ácido 2-aminoetanosulfónico, mejor conocido como taurina, un aminoácido esencial particularmente para los gatos.
La taurina sintética y la natural se emplean como suplementos en alimentos para mascotas y en productos farmacéuticos.
El ácido taurocólico es un componente de la bilis y participa en la digestión de las grasas. El ácido 8-anilino-1-naftalenosulfónico, un compuesto sintético, se usa en el estudio de las proteínas.
Los copolímeros de urea y ácido bifenildisulfónico se han empleado como inhibidores del virus del herpes simplex.
Algunos derivados de ácidos sulfónicos, como el poliestireno sulfonado y algunos azocompuestos, han mostrado propiedades de inhibición del virus de inmunodeficiencia humana o VIH, sin resultar excesivamente tóxicos contra las células anfitrionas.
Ciertas mezclas de derivados del petróleo, que incluyen una combinación variada de aromáticos, parafinas y aromáticos polinucleares, pueden ser sulfonadas y luego neutralizadas adecuadamente generando los llamados sulfonatos de petróleo.
Estos sulfonatos de petróleo tienen la propiedad de bajar la tensión superficial del petróleo en agua. Además, su producción es de muy bajo costo.
Por esta razón, los sulfonatos de petróleo se inyectan en pozos existentes de petróleo ayudando a la recuperación de crudo que se encuentra ocluido entre las rocas bajo la superficie.
Los sulfonatos de magnesio tienen amplio uso en fórmulas de lubricantes como aditivos dispersantes-detergentes y para evitar el desgaste.
Los sulfonatos de bario se emplean en lubricantes antifricción para cojinetes usados en aplicaciones de alta velocidad. Los sulfonatos de sodio y calcio tienen aplicación en lubricantes y grasas para engranajes para mejorar las propiedades de extrema presión.
Las sales de magnesio de ácidos sulfónicos también son útiles en aplicaciones anticorrosivas como recubrimientos, grasas y resinas.
- Falk, Michael and Giguere, Paul A. (1958). On the nature of sulphurous acid. Canadian Journal of Chemistry, Vol. 36, 1958. Recuperado de nrcresearchpress.com
- Betts, R.H. and Voss, R.H. (1970). The kinetics of oxygen exchange between the sulfite ion and water. Canadian Journal of Chemistry, Vol. 48, 1970. Recuperado de nrcresearchpress.com
- Cotton, F.A. and Wilkinson, G. (1980). Advanced Inorganic Chemistry. Fourth Edition. Chapter 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 23. Fourth Edition. John Wiley & Sons.
- Kosswig, Kurt. (2012). Surfactants. Ullmann’s Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.
