Agar EMB: fundamento, preparación y uso
El agar EMB es un medio de cultivo sólido selectivo y diferencial utilizado para el aislamiento de bacilos Gram negativos, principalmente de la familia Enterobacteriaceae, y otros bacilos Gram negativos no exigentes. También se le conoce con las siglas EAM, que significa eosina-azul de metileno.
Este medio fue creado por Holt-Harris y Teague en 1916. Contiene peptona, lactosa, sacarosa, fosfato dipotásico, agar, eosina, azul de metileno y agua. Es muy similar al agar MacConkey, sobre todo si se usa el agar EMB modificado por Levine, que no contiene sacarosa.
De hecho, cada laboratorio decide si trabaja con uno o con otro, ya que cumplen la misma función, aunque bioquímicamente sean diferentes.
Incluso presenta el mismo inconveniente que el agar MacConkey clásico en cuanto a la producción de swarming por el género Proteus. Por tanto, para evitar este fenómeno se puede aumentar la concentración del agar hasta en un 5%.
Índice del artículo
El agar EMB es sutilmente selectivo porque contiene los colorantes anilínicos (eosina y azul de metileno), los cuales actúan como inhibidores, impidiendo el crecimiento de la mayoría de las bacterias Gram positivas y de algunos bacilos Gram negativos exigentes.
Sin embargo, este agar tiene el inconveniente de que algunas bacterias Gram positivas pueden resistir la presencia de las sustancias inhibidoras y crecer como pequeñas colonias puntiformes incoloras, tal como el Enterococcus faecalis y algunos Staphylococcus.
También pueden crecer ciertas levaduras, como el complejo Candida albicans, que dará colonias rosadas muy pequeñas. Inclusive se pueden desarrollar clamidosporas a partir de esta levadura si la muestra es sembrada por profundidad.
Por otra parte, el agar EMB también es un medio diferencial, ya que estos colorantes juntos (eosina y azul de metileno) tienen la propiedad de formar un precipitado en pH ácido, por tanto sirven como indicadores de la producción del mismo.
Por ello, las bacterias débilmente fermentadoras de lactosa o sacarosa producen colonias de color púrpura en 24 a 48 horas. Por ejemplo los géneros Klebsiella, Enterobacter y Serratia.
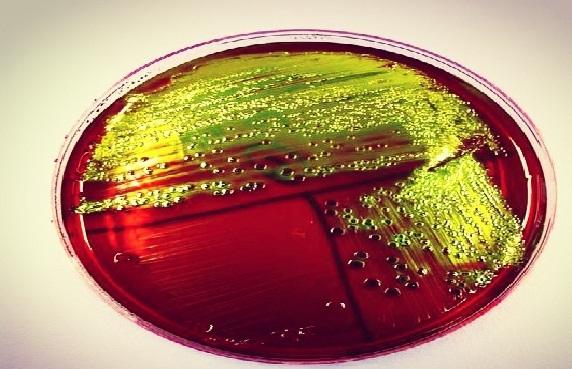
Aquellas bacterias que fermentan fuertemente la lactosa, como Escherichia coli, o la sacarosa, como Yersinia enterocolítica o Proteus penneri, forman un precipitado negro verdoso, dando un aspecto de brillo metálico característico en estas especies.
Cabe destacar que si se usa el medio EMB levine (sin sacarosa), Yersinia enterocolítica y Proteus penneri producirán colonias transparentes.
Las bacterias que no fermentan la lactosa ni la sacarosa se nutren por la presencia de peptonas, que proporcionan los aminoácidos y el nitrógeno necesario para el desarrollo bacteriano, y producen colonias transparentes. Por ejemplo, los géneros Salmonella y Shigella, entre otros.
Así mismo, es importante destacar que el género Acinetobacter puede presentar colonias de color azul lavanda, aun cuando no es fermentador de lactosa, ni sacarosa, pero tienen la propiedad de fijar el azul de metileno en su pared celular. Esto también puede suceder con otras bacterias oxidativas.
El medio original deshidratado es de color beige claro.
Para preparar este medio de cultivo se deben pesar 36 gramos del medio deshidratado y suspenderlo en una fiola que contenga un litro de agua destilada.
Después de dejar la mezcla 5 minutos en reposo, llevar la fiola a una fuente de calor, mezclando de forma vigorosa y constante hasta que hierva y se logre disolver totalmente.
Posteriormente, se debe esterilizar el medio de cultivo ya disuelto utilizando el autoclave a 121 °C durante 15 minutos.
Terminado el tiempo, se saca del autoclave y se deja reposar brevemente. Luego se sirve aun caliente (45 – 50°C) entre 15 a 20 ml de agar en cada placa de Petri estéril. El medio debe ser azul tornasol.
Después de servidas las placas se dejan ligeramente destapadas hasta que el agar enfríe un poco. Luego se tapan y se deja que solidifiquen completamente. Posteriormente se ordenan en porta plaqueros en forma invertida y se guardan en nevera (8°C) hasta su uso.
Este procedimiento se realiza preferiblemente en una campana de flujo laminar o frente al mechero de Bunsen para evitar que se contaminen.
Es importante tener presente que cada casa comercial indicará la cantidad a pesar para preparar el medio de cultivo.
El pH final del medio debe ser de 7.2 ± 0.2
Este medio se utiliza para sembrar orina y heces o cualquier tipo de muestras clínicas, especialmente si se sospecha de la presencia de bacilos Gram negativos no exigentes, como los bacilos pertenecientes a la familia Enterobacteriaceae, que crece muy bien en este medio.
Las bacterias enteropatógenas de los géneros Shigella y Salmonella se distinguen por sus colonias incoloras o ligeramente ámbar.
También crecen otros bacilos no fermentadores de lactosa como Aeromonas, Pseudomonas, Acinetobacter, entre otros.
Así mismo, este medio es muy útil en el análisis microbiológico de alimentos y aguas, pues es ideal para la fase completa confirmatoria de la determinación de coliformes, es decir, para corroborar la presencia de E. coli a partir de caldos EC turbios, provenientes de la técnica del número más probable (NMP).
Para verificar que el medio de cultivo recién preparado funciona bien, se pueden sembrar cepas controles para observar las características de las colonias y constatar que den conforme a lo esperado.
Para ello, se pueden usar cepas ATCC o cepas bien identificadas de E. coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa y algunas bacterias Gram positivas, como S. aureus.
Se espera que E. coli genere colonias bien desarrolladas color negro azulado con brillo metálico verde. En tanto que, Enterobacter aerogenes y Klebsiella sp deben dar colonias mucosas bien desarrolladas color negro azulado.
Por su parte, Salmonellatyphimurium y Shigella flexneri, deben desarrollar colonias grandes, incoloras o con un ligero color ámbar.
Finalmente el género Pseudomonas aeruginosa crece como colonias incoloras de tamaño irregular, mientras que las bacterias Gram positivas deberían ser inhibidas totalmente o crecer de forma escasa con colonias muy pequeñas.
Algunas veces la esterilización hace que el azul de metileno se reduzca, observándose un medio color naranja. Para que el azul de metileno se oxide y se recupere el color púrpura se debe mezclar suavemente hasta recuperar el color.
También, después del esterilizado puede precipitar el colorante, por lo que se debe mezclar bien antes de servir a las placas de Petri.
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B y Velázquez O. 2009. Técnicas para el Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química, UNAM. México.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Caracterización y Distribución de Cepas de Escherichia coli Potencialmente Patógenas Aisladas de Pollos Broiler de Explotaciones Avícolas en el Perú. Rev. investig. vet. Perú 2012 23 (2): 209-219. Disponible en: scielo.org.
- Laboratorios Conda S.A. Agar Eosina y Azul de Metileno. 2010. Disponible en: condalab.com
- Laboratorios Britania. Levine E.M.B (Con Eosina y Azul de Metileno) 2011. Disponible en: britanialab.com
- Laboratorios BD. BD EMB Agar (Eosin Methylene Blue Agar), Modified. 2013. Disponible en: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. (5ta ed.). Argentina, Editorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A
