Electrodo de calomel: funcionamiento, características, usos
El electrodo de calomel o calomelanos es un electrodo secundario que permite determinar potenciales de semiceldas, gracias a la reacción que ocurre entre el mercurio y el cloruro de mercurio (I), Hg2Cl2, conocido antiguamente como calomel. Ambos reactivos, Hg y Hg2Cl2, ganan o pierden electrones dependiendo del medio en que se sumerge el electrodo.
Abreviado normalmente como EC, este electrodo sustituye en muchas mediciones al electrodo estándar de hidrógeno (SHE por sus siglas en inglés), ya que es más fácil de construir, y menos riesgoso de manipular (pese a tener mercurio). En su interior contiene una solución de KCl como medio electrolítico para el flujo de los electrones.

El electrodo de calomel puede tener distintas variantes dependiendo de su tamaño, o más importante, de la concentración del KCl. Cuando la solución de KCl está saturada, hablamos de un electro de calomel saturado (ESC). El ESC es más fácil de preparar que el EC, pero más sensible a los cambios de temperatura.
El uso de este electrodo ha permitido determinar los potenciales de semiceldas para innumerables reacciones redox. Asimismo, es un dispositivo recurrente en las determinaciones potenciométricas, las cuales buscan conocer la cantidad de analito en función del potencial de celda E medido.
Índice del artículo
Para que el electrodo de calomel funcione, el par Hg-Hg2Cl2 debe reaccionar, ya sea ganando o perdiendo electrones.
Cuando en el interior del electrodo de calomel se da la reducción o la ganancia de electrones, tenemos las siguientes reacciones:
Hg2Cl2 → Hg22+ + 2Cl– (Ionización)
Hg22+ + 2e– → 2Hg (Reducción)
Hg2Cl2 + 2e– → 2Hg + 2Cl– (Reacción neta)
Por lo tanto, el Hg2Cl2 gana electrones reduciéndose a mercurio metálico.
El potencial E del electrodo cuando ocurre la reducción viene dado por la ecuación:
E = Eº – 0.0591 Log [Cl–]
Donde se observa que E depende exclusivamente de la concentración de los iones Cl–, siendo Eº el potencial de reducción estándar para este electrodo medido frente al electrodo estándar de hidrógeno.
Dentro del electrodo también puede ocurrir un proceso de oxidación:
2Hg → Hg22+ + 2e– (Oxidación)
Hg22+ + 2Cl– → Hg2Cl2 (Precipitación)
2Hg + 2Cl– → Hg2Cl2 + 2e– (Reacción neta)
Es decir, que el mercurio se oxida para generar más Hg2Cl2.
El potencial E en este caso viene dado por:
E = Eº + 0.0591 Log [Cl–]
Y nuevamente, E depende de [Cl–].
La reacción general para el electrodo de calomel viene a ser:
Hg2Cl2(s) + 2e– ⇌ 2Hg(l) + 2Cl–
El sentido del equilibrio de arriba dependerá del medio en donde se ponga en contacto el electrodo. El ion Cl– determina la solubilidad del Hg2Cl2, que a su vez repercute en la formación u oxidación del Hg.
Y el potencial determinado para una concentración especificada de iones Cl– será igual a:
Ecalomel = Ered – Eox
Siendo Ecalomel el potencial que viene reportado como referencia en determinadas tablas de potenciales.
La semicelda del electrodo de calomel se puede representar como sigue:
Pt| Hg| Hg2Cl2| Cl– (xM)
Donde solo tiene importancia la concentración de los iones Cl–, expresada en molaridad o normalidad. El potencial E del electrodo variará si se llena con soluciones de distintas concentraciones de KCl.
Por ejemplo, un EC con KCl 0.1 M tiene un E igual a 0.3356 V a 25 ºC; mientras que el ESC, con KCl saturado, tiene un E igual a 0.2444 V a la misma temperatura.
Por lo tanto, la concentración del KCl es la característica más importante de los electrodos de calomel, pues indicará qué E utilizar cuando se realicen los cálculos de las mediciones potenciométricas.
Comercialmente, se consiguen tres tipos de electrodos de calomel: el saturado (ESC), el decimonormal (0.1 N o 0.1 M KCl) y el normal (1 N o 1 M KCl). Un electrodo de calomel 1 M KCl se representaría como:
Pt| Hg| Hg2Cl2| Cl– (1 M)
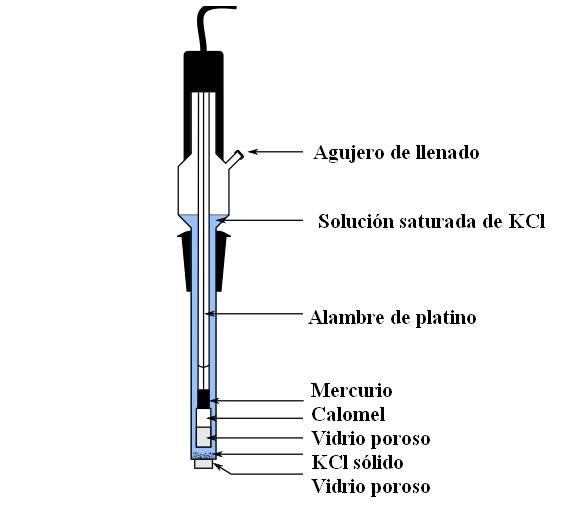
En la imagen superior mostramos las principales partes de un electrodo de calomel ordinario. Está hecho de vidrio, y consta de dos recipientes: uno externo, el que se pone en contacto electroquímico con el medio de las mediciones y contiene la solución de KCl; y uno interno, donde reposa la mezcla Hg-Hg2Cl2.
Internamente, el electrodo de calomel contiene mercurio líquido, sobre el cual se adhiere una pasta de Hg2Cl2 humedecido con mercurio. Esta es la fase más activa del electrodo. El vidrio poroso sirve para permitir únicamente la entrada o salida de los iones Cl–, pero no de los cristales de Hg2Cl2 o de las gotas de mercurio.
Un cable de platino, por donde fluyen los electrones, está sumergido en el mercurio, y es el responsable de conectar el electrodo con el voltímetro y el circuito externo en cuestión.
A través del agujero de llenado se vierte la solución de KCl, la cual contiene cristales no disueltos de la sal. Mientras, en la parte de abajo del electrodo tenemos una abertura muy pequeña en un vidrio poroso, el cual entra en contacto directo con el medio de las mediciones. El propósito del vidrio poroso es permitir el contacto sin intercambios indeseables de sustancias que contaminen el electrodo o la muestra.
El electrodo de calomel presenta las siguientes ventajas respecto al electrodo estándar de hidrógeno:
-Fácil de construir y manipular
-Su potencial de celda permanece constante aun si el agua se evapora
-No necesita de un puente salino
El ESC es el más fácil de construir de los electrodos de calomel, pues basta con disolver KCl en agua hasta que se formen sus cristales. Entonces la solución estará saturada, y lista para verterse dentro del electrodo.
El electrodo de calomel, no obstante, presenta las siguientes desventajas:
-Al contener mercurio líquido puede llegar a ejercer un impacto negativo en el medio ambiente
-No puede utilizarse para análisis cuantitativos en muestras con una temperatura superior a los 60 ºC, ya que el Hg2Cl2 comienza a descomponerse, ocasionando que fallen las lecturas del electrodo
El ESC tiene además la desventaja de que es muy sensible a los cambios de temperatura.
El electrodo de plata-cloruro de plata ha sustituido al de calomel en muchas de las determinaciones potenciométricas.
El electrodo de calomel es uno de los tantos electrodos que se utilizan cotidianamente en las determinaciones potenciométricas, permitiendo obtener los potenciales de semiceldas de los analitos o de las especies de interés.
Asimismo, el electrodo de calomel se utiliza en las mediciones de pH y en la voltametría cíclica.
- Day, R., & Underwood, A. (1986). Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
- Wikipedia. (2020). Saturated calomel electrode. Recuperado de: en.wikipedia.org
- Generalic, Eni. (20 de octubre de 2018). Calomel electrode. Croatian-English Chemistry Dictionary & Glossary. KTF-Split. 30 Oct. 2020. Recuperado de: glossary.periodni.com
- Skoog D.A., West D.M. (1986). Análisis instrumental. (segunda ed.). Interamericana., México.
- Hills, G., Ives, D. T. (1950). The Calomel Electrode. Nature 165, 530 doi.org/10.1038/165530a0
- Jmgav. (09 de diciembre de 2012). Potenciometría (II): los electrodos. Recuperado de: triplenlace.com
