Holmio: qué es, historia, propiedades, estructura, usos

¿Qué es el holmio?
El holmio es un elemento metálico perteneciente al bloque f de la tabla periódica, específicamente al período de los lantánidos. Es por tanto miembro de las tierras raras, junto al erbio, itrio, disprosio e iterbio. Todos estos componen una serie de minerales (xenotima o gadolinita) que son difíciles de separar mediante métodos químicos convencionales.
Su símbolo químico es el Ho, teniendo un número atómico de 67, y siendo menos abundante que sus vecinos disprosio (66Dy) y erbio (68Er). Se dice entonces que obedece la regla de Oddo-Harkins. El holmio es uno de esos metales raros que casi nadie conoce ni sospecha de su existencia; aun entre químicos, no suele mencionarse con mucha frecuencia.
En los ámbitos de la medicina, al holmio se le conoce por la utilización de su láser en cirugías para combatir patologías de la próstata. Asimismo, representa el material prometedor para la fabricación de electroimanes y ordenadores cuánticos, debido a sus inusuales propiedades magnéticas.
Los compuestos de holmio, de carácter trivalente, Ho3+, presentan la particularidad de exhibir una coloración dependiente de la luz con que se les irradie. Si esta es fluorescente, el color de dichos compuestos cambia de amarillo a rosado. De igual modo, sucede con sus disoluciones.
Historia
El descubrimiento del holmio se le atribuye a dos químicos suizos, Marc Delafontaine y Jacques-Louis Soret, quienes en 1878 lo detectaron espectroscópicamente mientras analizaban en Ginebra minerales de tierras raras. Le llamaron el elemento X.
Apenas un año después, en 1879, el químico sueco Per Teodor Cleve logró separar el óxido de holmio partiendo de erbia, óxido de erbio (Er2O3). Este óxido, contaminado por otras impurezas, mostró una coloración marrón, al cual nombró ‘holmia’, que significa Estocolmo en latín.
Asimismo, Cleve obtuvo otro material de color verde: ‘thulia’, el cual viene a ser el óxido de tulio. El problema de este descubrimiento es que ninguno de los tres químicos pudo obtener una muestra lo suficiente pura del óxido de holmio, ya que estaba contaminada por átomos de disprosio, otro metal lantánido.
No fue sino en 1886 que el afanado químico francés, Paul Lecoq de Boisbaudran, aisló el óxido de holmio mediante precipitación fraccionada. Este óxido posteriormente se sometió a reacciones químicas para producir sales de holmio, las cuales se redujeron en 1911 por el químico sueco Otto Holmberg; y así, apareció las primeras muestras de holmio metálico.
No obstante, en la actualidad los iones de holmio, Ho3+, se extraen por cromatografía de intercambio iónico, en lugar de recurrir a las reacciones convencionales.
Propiedades del holmio
Apariencia física
Metal plateado, blando, dúctil y maleable.
Número atómico
67 (67Ho)
Masa molar
164,93 g/mol
Punto de fusión
1461 ºC
Punto de ebullición
2600 ºC
Densidad
A temperatura ambiente: 8,79 g/cm3
Justo cuando se derrite o funde: 8,34 g/cm3
Calor de fusión
17 kJ/mol
Calor de vaporización
251 kJ/mol
Capacidad calorífica molar
27,15 J/(mol·K)
Electronegatividad
1,23 en la escala de Pauling
Energías de ionización
Primera: 581,0 kJ/mol (Ho+ gaseoso)
Segunda: 1140 kJ/mol (Ho2+ gaseoso)
Tercera: 2204 kJ/mol (Ho3+ gaseoso)
Conductividad térmica
16,2 W/(m·K)
Resistividad eléctrica
814 nΩ·m
Números de oxidación
El holmio puede presentarse en sus compuestos con los siguientes números o estados de oxidación: 0, +1 (Ho+), +2 (Ho2+) y +3 (Ho3+). De todos ellos, el +3 es por mucho el más común y estable. Por lo tanto, el holmio es un metal trivalente, formando compuestos (iónicos o parcialmente iónicos) donde participa como ion Ho3+.
Por ejemplo, en los siguientes compuestos el holmio se encuentra con número de oxidación de +3: Ho2O3 (Ho23+O32-), Ho(OH)3, HoI3 (Ho3+I3–) y Ho2(SO4)3.
El Ho3+ y sus transiciones electrónicas son responsables de que los compuestos de este metal luzcan colores marrón-amarillos. Sin embargo, cuando estos se irradian con luz fluorescente, se tornan rosados. Lo mismo ocurre con sus disoluciones.
Isótopos
El holmio se presenta en la naturaleza como un único isótopo estable: 165Ho (100% de abundancia). No obstante, existen radioisótopos artificiales con tiempos de vida media considerables. Entre ellos tenemos:
–163Ho (t1/2 = 4570 años)
–164Ho (t1/2 = 29 minutos)
–166Ho (t1/2 = 26,763 horas)
–167Ho (t1/2 = 3,1 horas)
Orden y momento magnéticos
El holmio es un metal paramagnético, pero puede volverse ferromagnético a una temperatura de 19 K, exhibiendo propiedades magnéticas muy fuertes. Se caracteriza por tener además el momento magnético (10,6 μB) más grande entre todos los elementos químicos, así como una inusual permeabilidad magnética.
Reactividad
El holmio es un metal que en condiciones normales no se oxida demasiado rápido, por lo que demora en perder su brillo. Sin embargo, cuando se le calienta con un mechero se torna amarillento, producto de la formación de una capa de óxido:
4 Ho + 3 O2 → 2 Ho2O3
Reacciona con ácidos diluidos o concentrados para originar sus respectivas sales (nitratos, sulfatos, etc.). No obstante y sorprendentemente, no reacciona con el ácido fluorhídrico, ya que una capa de HoF3 lo protege de su degradación.
El holmio asimismo reacciona con todos los halógenos para producir sus respectivos halogenuros (HoF3, HoCl3, HoBr3 y HoI3).
Estructura química
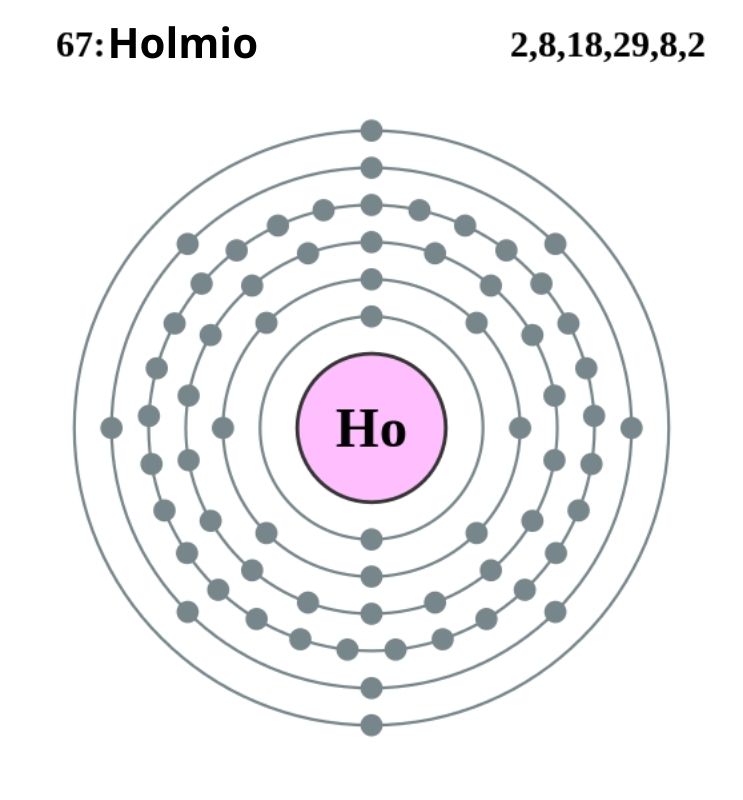
El holmio cristaliza en una estructura hexagonal compacta, hcp (por sus siglas en inglés: hexagonal close-packed). En teoría, los átomos Ho se mantienen cohesionados gracias al enlace metálico formado por los electrones de sus orbitales 4f, de acuerdo a su configuración electrónica:
[Xe] 4f11 6s2
Tales interacciones, así como el ordenamiento energético de sus electrones, definen las propiedades físicas del holmio. A este metal no se le conoce ningún otro alótropo o polimorfo, ni siquiera bajo altas presiones.
Usos
Reacciones nucleares
El átomo de holmio es un buen absorbente de neutrones, por lo que ayuda a controlar el desarrollo de las reacciones nucleares.
Espectroscopia
Las disoluciones de óxido de holmio se utilizan para calibrar los espectrofotómetros, debido a que su espectro de absorción permanece constante casi siempre, sin importar las impurezas que contenga. Muestra además bandas agudas muy características asociadas al átomo de holmio, y no a sus compuestos.
Colorante
Los átomos de holmio son capaces de aportar coloraciones rojizas a vidrios y a gemas artificiales de circonia cúbica.
Imanes
A temperaturas extremadamente bajas (30 K o menos), el holmio exhibe propiedades magnéticas interesantes, las cuales se utilizan para fabricar poderosos electroimanes, donde ayuda concentrar el campo magnético resultante.
Tales materiales magnéticos se destinan para resonancia magnética nuclear; para el desarrollo de discos duros, con memorias que oscilan en el orden de los petabytes o terabytes; y para posiblemente la fabricación de ordenadores cuánticos.
Láser de holmio
Un cristal de granate de itrio-aluminio (YAG) puede doparse con átomos de holmio para emitir una radiación cuya longitud de onda es de 2 μm; es decir, tenemos un láser de holmio. Gracias a él se puede cortar de manera precisa tejido tumoral sin causar sangrados, ya que la energía suministrada cauteriza las heridas de inmediato.
Este láser se ha utilizado recurrentemente en cirugías prostáticas y dentales, así como para eliminar células cancerígenas y cálculos renales.
